题目内容
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的离子不含电子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)E元素在元素周期表中的位置是
(2)由A、B、C三种元素形成的离子晶体的化学式为 。
(3)A、C、E间可形成甲、乙两种三原子分子,且甲有18个电子、乙有10个电子,甲与乙比较,沸点较高的是(填化学式) ,用符号和分子的结构式表示出沸点较高的原因为(至少写出两分子) 。
(4)F含有的化学键类型是 ,其水溶液呈酸性,请用相关的离子方程式解释其原因
。
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为 。
(1)E元素在元素周期表中的位置是
(2)由A、B、C三种元素形成的离子晶体的化学式为 。
(3)A、C、E间可形成甲、乙两种三原子分子,且甲有18个电子、乙有10个电子,甲与乙比较,沸点较高的是(填化学式) ,用符号和分子的结构式表示出沸点较高的原因为(至少写出两分子) 。
(4)F含有的化学键类型是 ,其水溶液呈酸性,请用相关的离子方程式解释其原因
。
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为 。
(14分)(1)第三周期 VIA (2)NH4NO3 NH4NO2 NH5(任写两个)
(3) H2O;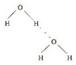 (4)离子键和共价键; NH4+ + H2O
(4)离子键和共价键; NH4+ + H2O NH3?H2O + H+
NH3?H2O + H+
(5)2Na2O2 + 2H2O =" 4NaOH" + O2↑
(3) H2O;
 (4)离子键和共价键; NH4+ + H2O
(4)离子键和共价键; NH4+ + H2O NH3?H2O + H+
NH3?H2O + H+(5)2Na2O2 + 2H2O =" 4NaOH" + O2↑
根据元素的结构及有关性质可知,A、B、C、D、E五种短周期元素分别是H、N、O、Na、S,F是硝酸铵。
(1)S的原子序数为16,所以S元素在元素周期表中的位置是第三周期 VIA 。
(2)H、N、O三种元素形成的离子晶体的化学式为NH4NO3或NH4NO2或NH5。
(3)甲和乙分别是H2S和H2O。由于水分子间存在氢键,所以水的沸点高于H2S的。
(4)硝酸铵中含有离子键和共价键,该化合物是强酸弱碱盐,水解显酸性,方程式为NH4+ + H2O NH3?H2O + H+。
NH3?H2O + H+。
(5)两种化合物分别是过氧化钠和水,反应的方程式为2Na2O2 + 2H2O =" 4NaOH" + O2↑。
(1)S的原子序数为16,所以S元素在元素周期表中的位置是第三周期 VIA 。
(2)H、N、O三种元素形成的离子晶体的化学式为NH4NO3或NH4NO2或NH5。
(3)甲和乙分别是H2S和H2O。由于水分子间存在氢键,所以水的沸点高于H2S的。
(4)硝酸铵中含有离子键和共价键,该化合物是强酸弱碱盐,水解显酸性,方程式为NH4+ + H2O
 NH3?H2O + H+。
NH3?H2O + H+。(5)两种化合物分别是过氧化钠和水,反应的方程式为2Na2O2 + 2H2O =" 4NaOH" + O2↑。

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
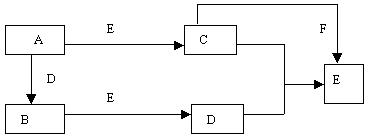
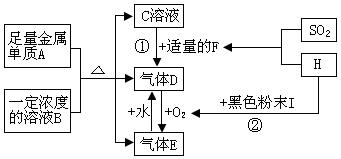


 .
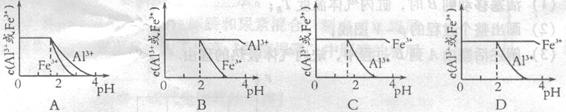
.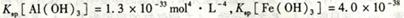 mol4·L一4。现向pH=0,浓度均为0.04mol·L-1的Al3+、Fe3+溶液中加入A的最高价氧化物对应水化物的溶液,以调节pH(设溶液体积不变),该过程中Al3+、Fe3+的浓度与pH关系正确的是
mol4·L一4。现向pH=0,浓度均为0.04mol·L-1的Al3+、Fe3+溶液中加入A的最高价氧化物对应水化物的溶液,以调节pH(设溶液体积不变),该过程中Al3+、Fe3+的浓度与pH关系正确的是