题目内容
【题目】青蒿素是从黄花蒿中提取的一种无色针状晶体,双氢青蒿素是青蒿素的重要衍生物,抗疟疾疗效优于青蒿素,请回答下列问题:
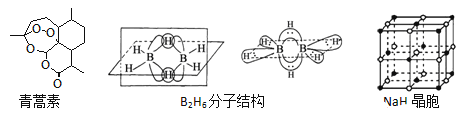
(1)组成青蒿素的三种元素电负性由大到小排序是__________,画出基态O原子的价电子排布图__________。
(2)一个青蒿素分子中含有_______个手性碳原子。
(3)双氢青蒿素的合成一般是用硼氢化钠(NaBH4)还原青蒿素.硼氢化物的合成方法有:
2LiH+B2H6=2LiBH4; 4NaH+BF3═NaBH4+3NaF
①写出BH4﹣的等电子体_________(分子、离子各写一种);
②B2H6分子结构如图,2个B原子和一个H原子共用2个电子形成3中心二电子键,中间的2个氢原子被称为“桥氢原子”,它们连接了2个B原子.则B2H6分子中有______种共价键,B原子的杂化方式为________ ;
③NaBH4的阴离子中一个B原子能形成4个共价键,而冰晶石(Na3AlF6)的阴离子中一个Al原子可以形成6个共价键,原因是______________;
④NaH的晶胞如图,则NaH晶体中阳离子的配位数是_________;设晶胞中阴、阳离子为刚性球体且恰好相切,求阴、阳离子的半径比![]() =__________。
=__________。
【答案】 O>C>H ![]() 7 CH4、NH4+ 2 sp2 B原子价电子层上没有d轨道,Al原子价电子层上有d轨道 6 0.414
7 CH4、NH4+ 2 sp2 B原子价电子层上没有d轨道,Al原子价电子层上有d轨道 6 0.414
【解析】本题考查《物质结构》电负性、核外电子排布图、等电子体、杂化类型、晶胞等,从基础知识入手,(1)青蒿素中含有的元素是H、C、O,非金属性越强,电负性越强,电负性强弱顺序是O>C>H,价电子对主族元素来说,是最外层电子,O原子价电子6个电子,每一个轨道最多容纳2个电子,自旋方向相反,优先单独占据一个轨道,自旋方向相同,其价电子排布图为 ;(2)手性碳原子是连有4个不同的原子或原子团,
;(2)手性碳原子是连有4个不同的原子或原子团,
因此青蒿素有7个手性碳原子;(3)①等电子体:原子总数相同,价电子总数相同的微粒互称,BH4-中含有5个电子,价电子总数为8,等电子体为CH4、NH4+等;②一个B形成3个B-H键,另一个B-H键是配位键,因此有2种共价键,B的有3个σ键,无孤电子对,因此杂化类型为sp2;③B原子价电子层上没有d轨道,Al原子价电子层上有d轨道;④离子晶体中配位数是异性离子的个数,Na+的配位数为6,晶胞中阴阳离子为刚性球体且恰好相切,设晶胞的边长为a,图应是: ,阴阳离子最近距离为a/2,阳离子半径是面对角线的1/4,阳离子半径为
,阴阳离子最近距离为a/2,阳离子半径是面对角线的1/4,阳离子半径为![]() a/4,阴离子半径为a/2-
a/4,阴离子半径为a/2-![]() a/4,
a/4,![]() =(a/2-
=(a/2-![]() a/4)/
a/4)/![]() a/4=0.414。
a/4=0.414。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案【题目】甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)反应②是________________(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如左下图所示。则平衡状态由A变到B时,平衡常数K(A)_____________K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。
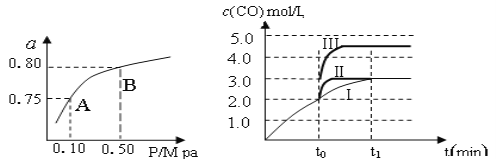
(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如右上图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_____________________。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________________。
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。

请写出加入(通入)b物质一极的电极反应式_________________;
每消耗6.4g甲醇转移的电子数为_______________。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________。


