��Ŀ����
����Ŀ��������ѧ֪ʶ�����Ŀ��
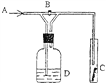
��1����ijͬѧΪ����֤������ԭ����ͭ�ķ�Ӧ����������ͼ1��ʾ��ʵ��װ�ã�
��д��������������ƣ����� ��
��Ũ����������� ��
�۱�ʵ����Ҫ���ȵ�װ��Ϊ������ĸ��ţ���
��д��װ��C��D�пɹ۲쵽������C �� D ��
��D�з�Ӧÿ����1molˮ���ӣ�ת�Ƶĵ�����Ϊ����
��2����ʵ��ʱ����Ҫ1.0mol/L��������Һ250mL��������Һ�����ƻش��������⣮������ͼ2��ʾ�����У�����������Һ�϶�����Ҫ����������ţ�����ͼ�����������⣬����������Һ����Ҫ�IJ��������� ��
��������ƿ��ʹ�÷����У����в�������ȷ����
A��ʹ������ƿǰ�����Ƿ�©ˮ
B������ƿ��ˮϴ�������ô�����Һϴ��
C��������Һʱ����������ǹ��壬�ѳƺõĹ�����ֽ��С�ĵ�������ƿ�У�������ˮ���ӽ��̶���1��2cm�����ý�ͷ�ιܼ�����ˮ���̶��ߣ�
D��������Һʱ����������Һ�壬����Ͳȡ�����ò�����������������ƿ�У�������ˮ���̶���1��2cm�����ý�ͷ�ιܼ�����ˮ���̶��ߣ�
E���Ǻ�ƿ������ʳָ��סƿ������һֻ����סƿ�ף�������ƿ������ת���Σ�ҡ�ȣ�
�۸��ݼ����֪��������Ͳ��ȡ��������Ϊ98%���ܶ�Ϊ1.84g/cm3��Ũ��������ΪmL�����ʵ������15mL��20mL��50mL��Ͳ��Ӧѡ��mL��Ͳ��ã�
���𰸡�
��1����ƿ������©��������������D����ɫ�����������ɫ��ĩ���ɫ��1.204��1024
��2��C���ձ�����������BCD��13.6��15
���������⣺��1����ͼ�Т���ƿ�ڳ���©�������Դ��ǣ���ƿ������©��������������Ũ���������Դ��ǣ������������ۻ�ԭ����ͭ��ʵ����Ҫ�ڸ����²ſ��Խ��У�������Ҫ���ȵ�װ����ĸ���ΪD�����Դ��ǣ�D����C������ˮ����ͭ����ˮ���ɰ�ɫ��Ϊ��ɫ��D���ú�ɫ����ͭ��ĩ�ڼ��ȵ������£���������ԭ�ɺ�ɫͭ����ɫ�仯���ɺ�ɫ��Ϊ��ɫ�����Դ��ǣ���ɫ�����������ɫ��ĩ���ɫ�����ڷ�ӦCuO+H2 ![]() Cu+H2O�У����ϼ�����ֵ=���ϼ۽���ֵ=ת�Ƶ�����=2NA=1.204��1024 �� ���Դ��ǣ�1.204��1024����2��������250ml1.0mol/Lϡ���ᣬ���������м��㡢��ȡ��ϡ�͡���Һ��ϴ����Һ�����ݡ�ҡ�ȵȲ�������Ͳ��ȡ���õ���ͷ�ιܣ�Ũ���ᣬ���ձ���ϡ�ͣ��ò��������裬��ȴ��ת�Ƶ�250mL����ƿ�У����ò�����������ϴ��2��3�Σ���ϴ��Һת�Ƶ�����ƿ�У���ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�����ݵߵ�ҡ�ȣ�������Ҫ������Ϊ���ձ���Ͳ������������250mL����ƿ����ͷ�ιܣ����Ի���Ҫ�������ǣ��ձ��������������Դ��ǣ�C���ձ�������������A��ʹ������ƿǰ�����Ƿ�©ˮ������ȷ��B������ƿ��ˮϴ���������ô�����Һϴ�ӣ���ˮ����Ӱ��ʵ�������ʴ���C��������Һʱ����������ǹ��壬�ѳƺõĹ��嵹���ձ����ܽ⣬����ƿ������Ϊ�ܽ��������ʴ���D��������Һʱ������ƿ������Ϊϡ��������Ӧ�����ձ���ϡ�ͣ��ʴ���E���Ǻ�ƿ������ʳָ��סƿ������һֻ����סƿ�ף�������ƿ������ת���Σ�ҡ�ȣ�����ȷ�� ���Դ��ǣ�BCD������������Ͳ��ȡ��������Ϊ98%���ܶ�Ϊ1.84g/cm3��Ũ��������ΪVmL����
Cu+H2O�У����ϼ�����ֵ=���ϼ۽���ֵ=ת�Ƶ�����=2NA=1.204��1024 �� ���Դ��ǣ�1.204��1024����2��������250ml1.0mol/Lϡ���ᣬ���������м��㡢��ȡ��ϡ�͡���Һ��ϴ����Һ�����ݡ�ҡ�ȵȲ�������Ͳ��ȡ���õ���ͷ�ιܣ�Ũ���ᣬ���ձ���ϡ�ͣ��ò��������裬��ȴ��ת�Ƶ�250mL����ƿ�У����ò�����������ϴ��2��3�Σ���ϴ��Һת�Ƶ�����ƿ�У���ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�����ݵߵ�ҡ�ȣ�������Ҫ������Ϊ���ձ���Ͳ������������250mL����ƿ����ͷ�ιܣ����Ի���Ҫ�������ǣ��ձ��������������Դ��ǣ�C���ձ�������������A��ʹ������ƿǰ�����Ƿ�©ˮ������ȷ��B������ƿ��ˮϴ���������ô�����Һϴ�ӣ���ˮ����Ӱ��ʵ�������ʴ���C��������Һʱ����������ǹ��壬�ѳƺõĹ��嵹���ձ����ܽ⣬����ƿ������Ϊ�ܽ��������ʴ���D��������Һʱ������ƿ������Ϊϡ��������Ӧ�����ձ���ϡ�ͣ��ʴ���E���Ǻ�ƿ������ʳָ��סƿ������һֻ����סƿ�ף�������ƿ������ת���Σ�ҡ�ȣ�����ȷ�� ���Դ��ǣ�BCD������������Ͳ��ȡ��������Ϊ98%���ܶ�Ϊ1.84g/cm3��Ũ��������ΪVmL���� ![]() �����V=13.6mL����Ҫ15mL����Ͳ�����Դ��ǣ�13.6��15��
�����V=13.6mL����Ҫ15mL����Ͳ�����Դ��ǣ�13.6��15��