题目内容
可逆反应:X+Y W+Z,反应速率(V)随时间(t)变化的
W+Z,反应速率(V)随时间(t)变化的 情况如图所示。
情况如图所示。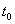 表示在其他条件不变的情况下,改变体系的一个条件(温度、浓度、压强)所引起的变化。则下列分析正确的是
表示在其他条件不变的情况下,改变体系的一个条件(温度、浓度、压强)所引起的变化。则下列分析正确的是
A.t0时条件改变引起的变化是平衡向正反应方向移动
B.若t0改变的条件是压强,则W、Z均为气体,X、Y中只有一种为气体
C.若t0改变的条件是温度,则该反应的正反应是吸热反应
D.若t0改变的条件是浓度,改变的方法是减小X、Y的浓度
B

练习册系列答案
相关题目
下列混合物的除杂方法与发生反应的类型均正确的是( )
| 混合物 | 加入试剂或方法 | 反应类型 | |
| A | 除去O2中的CO | 通入炽热的氧化铜中 | 化合反应 |
| B | 除去CO2中的HCl | 通入饱和碳酸氢钠溶液中 | 复分解反应 |
| C | 除去碳酸钙中的碳酸钠 | 溶解、加入氯化钡溶液 | 复分解反应 |
| D | 除去氯化钠中的碳酸钠 | 加入适量盐酸、蒸发 | 复分解反应 |
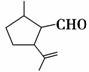 ,下列检验A中官能团的试剂和顺序正确的是
,下列检验A中官能团的试剂和顺序正确的是 HBr+H的能量对反应历程的示意图。
HBr+H的能量对反应历程的示意图。 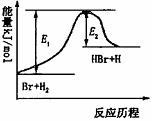
 Z(g)+2 W(g) △H<0, 反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
Z(g)+2 W(g) △H<0, 反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是