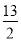题目内容
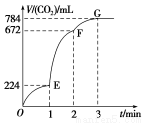
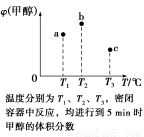
已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)  CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是( )
CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是( )
A.正反应的ΔH>0
B.反应进行到5 min时,b容器中v正=v逆
C.减压可将b中的平衡状态转变成c中的平衡状态
D.达到平衡时,a、b、c中CO的转化率为b>a>c
C
【解析】本题的关键点是温度不同,选取的时间是5 min,a肯定没有达到平衡,b可能达到平衡也可能没有,c肯定达到平衡。若三者均达到平衡,则甲醇的含量应依次降低,正反应是放热反应,A、B、D错误。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
下面是有关弱酸的电离平衡常数。
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 (25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
结合数据,分析下列有关说法,其中错误的是( )
A.1 mol·L-1的溶液中,pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.升高温度,HCN溶液中H+浓度增大,平衡正向移动,电离平衡常数增大
C.向稀醋酸中逐滴加水,或加入少量冰醋酸,CH3COOH的电离平衡都正向移动
D.向CH3COOH溶液中加入少量氢氧化钠固体,平衡正向移动