题目内容
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.7.8g苯含σ键的数目为0.6NA
B.将Cl2通入FeBr2溶液中,有1molBr2生成时,转移的电子数为2NA
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH![]() 的数目为NA
的数目为NA
D.有铁粉参加的反应若生成3molFe2+,则转移电子数一定为6NA
【答案】C
【解析】
A.苯中有6个碳碳σ键和6个碳氢σ键,则1mol苯中含有12molσ键,7.8g苯为0.1mol,含σ键的数目为1.2NA,故A错误;
B.亚铁离子的还原性大于溴离子,氯气通入溴化亚铁中先与亚铁离子反应,再与溴离子反应,则1molBr2生成时,转移的电子数大于2NA,故B错误;
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,根据电荷守恒:![]() ,因
,因![]() ,则
,则![]() ,
,![]() ,溶液中NH
,溶液中NH![]() 的数目为NA,故C正确;
的数目为NA,故C正确;
D.铁粉参加的反应,如![]() ,产生3mollFe2+转移电子数为2NA,故D错误;
,产生3mollFe2+转移电子数为2NA,故D错误;
故选:C。

练习册系列答案
相关题目
【题目】白桦脂酸对白血病等恶性肿瘤细胞有抑制作用,其结构简式如图所示,在白桦脂酸中加入合适的试剂检验其官能团(必要时可加热),下列试剂、现象、结论都正确的一项是
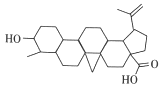
选项 | 试剂 | 现象 | 结论 |
A | 氯化铁溶液 | 溶液变色 | 含有羟基 |
B | 银氨溶液 | 有银镜产生 | 含有醛基 |
C | 碳酸氢钠溶液 | 有气泡产生 | 含有羧基 |
D | 酸性KMnO4溶液 | 溶液褪色 | 含有碳碳双键 |
A. AB. BC. CD. D