��Ŀ����
����Ŀ��ij��ѧ�о���ѧϰС���ij��ɫˮ���ijɷֽ��м��飬��֪��ˮ����ֻ���ܺ���K����Mg2����Fe3����Cu2����Al3����Ag����Ca2����CO32����SO42����Cl���е����������ӡ���С��ͬѧȡ100 mLˮ������ʵ�飬��ˮ�����ȵμ����ᱵ��Һ���ٵμ�1 mol��L��1�����ᣬʵ������г��������ı仯�����ͼ��ʾ��
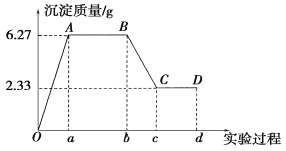
ע����Ob�α�ʾ�μ����ᱵ��Һ��bd�α�ʾ�μ�ϡ����
��1��ˮ����һ�����е���������________�������ʵ���Ũ��֮��Ϊ________��
��2��д��BC������ʾ��Ӧ�����ӷ���ʽ��__________________________________________��
��3����B�㵽C��仯������������������Ϊ________��
��4���Ը���ʵ�����ƶ�K���Ƿ���ڣ�________(����������������)�������ڣ�K�������ʵ���Ũ��c(K��)�ķ�Χ��__________________��(��K�������ڣ��ػش����)
��5����Ƽ�ʵ����֤ԭˮ���п��ܴ��ڵ����ӣ�_____________________��(д��ʵ�鲽�衢����ͽ���)
���𰸡�(1)S![]() ��C
��C![]() 1��2
1��2
(2)BaCO3+2H+====Ba2++CO2��+H2O (3)40 mL
(4)�� c(K+)��0��6 mol��L-1
(5)ȡ����ˮ�����Թ���,�����м�����������ᱵ��Һ��ϡ����,��������ȫ��,���ϲ���Һ�еμ���������Һ,��������ɫ����,��ԭˮ���к�Cl-,����������ɫ����,��ԭˮ���в���Cl-
��������
����(1)��ˮ��Ϊ��ɫ��Һ,Fe3+��Cu2+������,����ͼ������������ᱵ��Һ���ɳ���,����ϡ����,���������ܽ�֤��ˮ����һ������S![]() ��C
��C![]() ,����ΪC
,����ΪC![]() ��Ag+��Ca2+��Mg2+������Ӧ���ɳ������ܴ�������,����Ag+��Ca2+��Mg2+������;n(S
��Ag+��Ca2+��Mg2+������Ӧ���ɳ������ܴ�������,����Ag+��Ca2+��Mg2+������;n(S![]() )=
)=![]() =0��01 mol,m(BaCO3)=6��27 g-2��33 g=3��94 g,n(C
=0��01 mol,m(BaCO3)=6��27 g-2��33 g=3��94 g,n(C![]() )=
)=
n(BaCO3)=![]() =0��02 mol;c(S
=0��02 mol;c(S![]() )��c(C
)��c(C![]() )=1��2;(2)BC������ʾ��Ӧ��̼�ᱵ����ϡ����ķ�Ӧ,��Ӧ�����ӷ���ʽΪBaCO3+2H+====Ba2++CO2��+H2O;
)=1��2;(2)BC������ʾ��Ӧ��̼�ᱵ����ϡ����ķ�Ӧ,��Ӧ�����ӷ���ʽΪBaCO3+2H+====Ba2++CO2��+H2O;
(3)��B�㵽C��仯����������ͼ������ܽ��̼�ᱵ�����ʵ���n(BaCO3)
=0��02 mol;����ϡ�������ʵ���Ϊ0��04 mol,������������=![]() =0��04 L
=0��04 L
="40" mL;(4)���ݵ������Һ�ʵ�����,������K+һ������;���ݵ���غ�õ�:
0��01 mol��2+0��02 mol��2+n(Cl-)=n(K+)��֪n(K+)��0��06 mol,��c(K+)��
0��6 mol��L-1;(5)���ܴ��ڵ�������Cl-,ʵ�����Ϊ:ȡ����ˮ�����Թ���,���Թ��м�����������ᱵ��Һ��ϡ����,��������ȫ�����������ɺ�,���ϲ���Һ�еμ���������������Һ,�����ɰ�ɫ����,��ԭˮ���к���Cl-,���ް�ɫ��������,֤����Cl-���ڡ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�