题目内容
Ⅰ:用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答: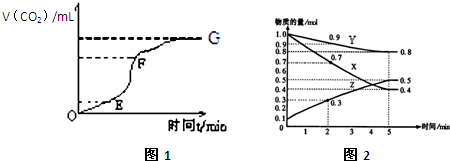
(1)实验过程如图1所示,分析判断:
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是
A.蒸馏水 B.氯化钠固体 C.氯化钠溶液 D.浓盐酸
Ⅱ:某温度时,在2L密闭容器中X、Y、Z三种物质随时间的变化关系曲线如图2所示.
(1)由图2中的数据分析,该反应的化学方程式为
(2)反应开始至2min时 Z的平均反应速率为
(3)5min后Z的生成速率比5min后Z的消耗速率

(1)实验过程如图1所示,分析判断:
E-F
E-F
段化学反应速率最快,E-F
E-F
段收集的二氧化碳气体最多.(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是
AC
AC
A.蒸馏水 B.氯化钠固体 C.氯化钠溶液 D.浓盐酸
Ⅱ:某温度时,在2L密闭容器中X、Y、Z三种物质随时间的变化关系曲线如图2所示.
(1)由图2中的数据分析,该反应的化学方程式为
3X(g)+Y(g)?2Z(g)
3X(g)+Y(g)?2Z(g)
(2)反应开始至2min时 Z的平均反应速率为
0.05mol/Lmin
0.05mol/Lmin
;(3)5min后Z的生成速率比5min后Z的消耗速率
相等
相等
(大、小、相等).分析:Ⅰ(1)根据v=
知,反应速率与体积的和时间的变化值之比成正比,△V越大的收集二氧化碳的体积越多;
(2)为减缓反应速率,根据题给信息知,可以通过改变反应物浓度控制;
Ⅱ(1)同一化学反应同一时间段内,参加反应的各物质的物质的量之比等于其计量数之比,从而写出反应方程式;
(2)根据v=
计算反应速率;
(3)当反应达到平衡状态时,同一物质的正逆反应速率相等.
| △V |
| △t |
(2)为减缓反应速率,根据题给信息知,可以通过改变反应物浓度控制;
Ⅱ(1)同一化学反应同一时间段内,参加反应的各物质的物质的量之比等于其计量数之比,从而写出反应方程式;
(2)根据v=
| ||
| △t |
(3)当反应达到平衡状态时,同一物质的正逆反应速率相等.
解答:解:Ⅰ(1)根据v=
知,反应速率与体积的和时间的变化值之比成正比,相同时间段内,体积变化越大的其反应速率越快,所以E-F段反应速率最快,△V越大的收集二氧化碳的体积越多,根据图象知,收集气体最多的是E-F段,
故答案为:E-F,E-F;
(2)为减缓反应速率,根据题给信息知,可以通过改变反应物浓度控制,所以能降低盐酸浓度的是加入水或加入氯化钠溶液,故选AC;
Ⅱ(1)随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增加,根据图象知,X和Y是反应物,Z是生成物,同一化学反应同一时间段内,参加反应的各物质的物质的量之比等于其计量数之比,
X物质的量变化量=(1-0.4)mol=0.6mol,Y物质的量变化量=(1-0.8)mol=0.2mol,Z物质的量变化量=(0.5-0.1)mol=0.4mol,所以X、Y、Z的计量数之比=0.6:0.2:0.4=3:1:2,则其化学反应方程式为:3X(g)+Y(g)?2Z(g),
故答案为:3X(g)+Y(g)?2Z(g);
(2)v=
=
=0.05mol/Lmin,故答案为:0.05mol/Lmin;
(3)当反应达到平衡状态时,同一物质的正逆反应速率相等,5min时该反应达到平衡状态,所以Z的生成速率比5min后Z的消耗速率相等,故答案为:相等.
| △V |
| △t |
故答案为:E-F,E-F;
(2)为减缓反应速率,根据题给信息知,可以通过改变反应物浓度控制,所以能降低盐酸浓度的是加入水或加入氯化钠溶液,故选AC;
Ⅱ(1)随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增加,根据图象知,X和Y是反应物,Z是生成物,同一化学反应同一时间段内,参加反应的各物质的物质的量之比等于其计量数之比,
X物质的量变化量=(1-0.4)mol=0.6mol,Y物质的量变化量=(1-0.8)mol=0.2mol,Z物质的量变化量=(0.5-0.1)mol=0.4mol,所以X、Y、Z的计量数之比=0.6:0.2:0.4=3:1:2,则其化学反应方程式为:3X(g)+Y(g)?2Z(g),
故答案为:3X(g)+Y(g)?2Z(g);
(2)v=
| ||
| △t |
| ||
| 2min |
(3)当反应达到平衡状态时,同一物质的正逆反应速率相等,5min时该反应达到平衡状态,所以Z的生成速率比5min后Z的消耗速率相等,故答案为:相等.
点评:本题考查了反应速率的影响因素、图象分析,物质的量浓度与反应速率成正比,注意化学平衡方程式的书写要写可逆号,为易错点.

练习册系列答案
相关题目
 用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答: