题目内容
下列有关金属及其化合物的说法正确的是 ( )
A.由于铝在常温下不能与氧气反应,所以铝制品具有一定的抗腐蚀性能,是一种应用广泛的金属材料
B.住FeCl3溶液中滴入KI一淀粉溶液,溶液变蓝色
C.向紫色石蕊试液中加入过量的Na2O2粉末,振荡,溶液变为蓝色并有气泡产生
D.装修门窗使用的铝合金材料的硬度比铝小,熔点比铝低
B
解析:铝在常温下能与氧气反应,并在铝的表面生成了一薄层致密的氧化物保护膜,所以铝制品具有一定的抗腐蚀性能。Na2 O2是强氧化剂,具有漂白性,紫色石蕊试液应先变蓝后褪色。铝合金材料的硬度比铝大。FeCl3与KI发生氧化还原反应,生成单质碘。

练习册系列答案
相关题目
 b
b  c
c 
 点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。
点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。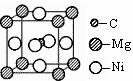

 b
b  c
c 

