题目内容
实验室用二氧化锰和浓盐酸反应制取氯气。
(1)若用200mL 10mol·L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化挥发),则产生氯气的物质的量为 0.50mol(填“大于”、“等于”或“小于”),原因是 。
(2)8.7g二氧化锰与足量的浓盐酸反应,则被氧化的氯化氢的物质的量是多少?产生的氯气在标准状况下的体积是多少?
(1)若用200mL 10mol·L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化挥发),则产生氯气的物质的量为 0.50mol(填“大于”、“等于”或“小于”),原因是 。
(2)8.7g二氧化锰与足量的浓盐酸反应,则被氧化的氯化氢的物质的量是多少?产生的氯气在标准状况下的体积是多少?
(8分)(1)小于 加热过程浓盐酸中HCl挥发掉部分;随着反应进行,浓盐酸变稀,稀盐酸不与二氧化锰反应。(2)被氧化的氯化氢的物质的量为0.2 mol,产生的氯气在标准状况下的体积是2.24L
试题分析:(1)盐酸的物质的量是0.2L×10mol/L=2mol,由于过程浓盐酸中HCl挥发掉部分;随着反应进行,浓盐酸变稀,稀盐酸不与二氧化锰反应,所以根据方程式MnO2 + 4H+ + 2Cl
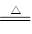 Mn2+ + 2H2O + Cl2↑可知,产生氯气的物质的量为小于0.50mol。
Mn2+ + 2H2O + Cl2↑可知,产生氯气的物质的量为小于0.50mol。(2)8.7g二氧化锰的物质的量是8.7g÷87g/mol=0.1mol,则根据方程式可知
MnO2 + 4HCl(浓)
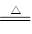 MnCl2+ 2H2O + Cl2↑
MnCl2+ 2H2O + Cl2↑1mol 4mol 22.4L
0.1mol 0.4mol 2.24L
所以被氧化的氯化氢的物质的量是0.4mol÷2=0.2mol
产生的氯气在标准状况下的体积是2.24L
点评:该题是中等难度的试题,试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑思维能力和发散思维能力。该的关键是明确稀盐酸不能被二氧化锰氧化,然后具体问题、具体分析即可。

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
 2NO2
2NO2