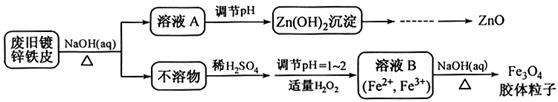
题目内容
某同学用如图所示的装置进行铜与浓硫酸反应的实验。
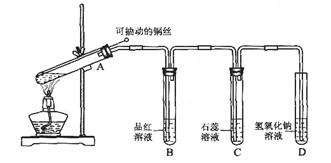
请回答:
(1)铜与浓硫酸反应的化学方程式是________________________
(2)实验过程中,观察到品红溶液________________,石蕊溶液________________,说明SO2________(填选项)。
a. 有氧化性 b. 有还原性 c. 有漂白性 d. 水溶液显酸性
(3)为进一步确认产生的气体是二氧化硫气体,还应补充的操作是________________
(4)结合离子方程式说明试管D中氢氧化钠溶液的作用是______________________
(5)把试管A中的液体冷却后慢慢倒入盛有水的烧杯里,观察到溶液呈________色,说明铜元素被氧化生成了________离子。

请回答:
(1)铜与浓硫酸反应的化学方程式是________________________
(2)实验过程中,观察到品红溶液________________,石蕊溶液________________,说明SO2________(填选项)。
a. 有氧化性 b. 有还原性 c. 有漂白性 d. 水溶液显酸性
(3)为进一步确认产生的气体是二氧化硫气体,还应补充的操作是________________
(4)结合离子方程式说明试管D中氢氧化钠溶液的作用是______________________
(5)把试管A中的液体冷却后慢慢倒入盛有水的烧杯里,观察到溶液呈________色,说明铜元素被氧化生成了________离子。
(11分)(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(2分)
CuSO4+SO2↑+2H2O(2分)
(2)褪色(1分) 变红(1分) cd(2分) (3)加热褪色后的品红溶液(1分)
(4)吸收逸出的SO2,SO2+2OH-=SO32-+H2O(2分)
(5)蓝(1分);铜(1分,写成Cu2+给分)
 CuSO4+SO2↑+2H2O(2分)
CuSO4+SO2↑+2H2O(2分)(2)褪色(1分) 变红(1分) cd(2分) (3)加热褪色后的品红溶液(1分)
(4)吸收逸出的SO2,SO2+2OH-=SO32-+H2O(2分)
(5)蓝(1分);铜(1分,写成Cu2+给分)
试题分析:(1)浓硫酸是氧化性酸,因此铜与浓硫酸反应的化学方程式是Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。(2)还原产物SO2具有漂白性,所以SO2通入到品红溶液中,溶液红色退去;SO2溶于水生成亚硫酸,溶液显酸性,所以通入到石蕊试液中,溶液显红色。
(3)由于SO2的漂白是不稳定的,加热后又能恢复到用来到颜色,所以为进一步确认产生的气体是二氧化硫气体,还应补充的操作是加热褪色后的品红溶液。
(4)SO2有毒,属于大气污染物,所以氢氧化钠溶液的作用是吸收逸出的SO2,反应的离子方程式是SO2+2OH-=SO32-+H2O。
(5)在反应中铜是还原剂,失去电子,被氧化生成硫酸铜,所以把试管A中的液体冷却后慢慢倒入盛有水的烧杯里,观察到溶液呈蓝色。2的性质以及尾气处理等
点评:该题是高考中的常见考点,属于中等难度的试题。试题基础性强,紧扣教材,有利于巩固学生的基础,提高学生的综合实验能力,也有利于培养学生的逻辑思维能力和环境保护意识,难度不大。

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目


 、NH
、NH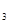 、C1
、C1