题目内容
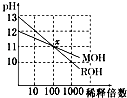
【题目】已知常温下0.1mol/L的NH4HCO3溶液pH=7.8,已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示.下列说法不正确的是( ) 
A.溶液的pH=9时,溶液中存在下列关系:c(HCO3﹣)>c(NH4+)>c(NH3H2O)>c(CO32﹣)
B.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3H2O)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3)
C.由图可知,往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3﹣浓度逐渐减小
D.通过分析可知常温下Ka1(H2CO3)>Kb(NH3H2O)>Ka2(H2CO3)
【答案】CD
【解析】解:A.结合图象可知,溶液的pH=9时,溶液中离子浓度大小为:c(HCO3﹣)>c(NH4+)>c(NH3H2O)>c(CO32﹣),故A正确;B.NH4HCO3溶液中存在物料守恒:c(NH4+)+c(NH3H2O)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3),故B正确;
C.0.1mol/L的NH4HCO3溶液的pH=7.8,根据图象可知,当溶液pH增大时,铵根离子浓度逐渐减小,而碳酸氢根离子能够先增大后减小,故C错误;
D.由于0.1mol/L的NH4HCO3溶液的pH=7.8,说明碳酸氢根离子的水解程度大于铵根离子的水解程度,则Kb(NH3H2O)大于Ka1(H2CO3),故D错误;
故选CD.
A.当pH=9时,结合图象判断溶液中各离子浓度大小;
B.根据碳酸氢铵溶液中的物料守恒分析;
C.该碳酸氢铵溶液的pH=7.8,结合图象判断滴入氢氧化钠溶液后NH4+和HCO3﹣浓度变化;
D.碳酸氢啊溶液显示碱性,根据盐的水解原理判断二者的酸碱性强弱及电离平衡常数大小.

【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下: 
(1)金属M为 , 操作1为 .
(2)加入H2O2的作用是(用离子方程式表示) , 加入氨水的作用是 .
(3)充分焙烧的化学方程式为 .
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是 , 90℃时Ksp(Li2CO3)的值为 .
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL﹣1 | 0.21 | 0.17 | 0.14 | 0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 .