题目内容
下列说法中,能说明化学平衡一定向正反应方向移动的是( )
分析:A、颜色加深,说明NO2浓度增大,增大浓度的方法很多,如:增大压强;恒容下加入N2O4或NO2;升高温度等;
B、改变某一条件,NH3的体积分数增大,可以采取措施:增大压强;恒容下加入N2或H2或NH3,降低温度等;
C、单位时间内消耗H2和HI的物质的量之比等于1:2,处于平衡状态,大于1:2,说明氢气的消耗速率大于生成速率;
D、恒温恒容充入He,反应混合气体各组分的浓度不变,平衡不移动.
B、改变某一条件,NH3的体积分数增大,可以采取措施:增大压强;恒容下加入N2或H2或NH3,降低温度等;
C、单位时间内消耗H2和HI的物质的量之比等于1:2,处于平衡状态,大于1:2,说明氢气的消耗速率大于生成速率;
D、恒温恒容充入He,反应混合气体各组分的浓度不变,平衡不移动.
解答:解:A、增大压强平衡向体积减小的方向移动,即向逆反应移动,NO2浓度增大,颜色加深.若恒容下加入N2O4,平衡向正反应移动,NO2浓度增大,颜色加深,所以平衡不一定向正反应移动,故A错误;
B、增大压强平衡向体积减小的方向移动,即向正反应方向移动,NH3的体积分数增大.增大氨气的浓度平衡向逆反应移动,移动的结果是降低氨气浓度增大的趋势,平衡时仍比原来的浓度高,所以平衡不一定向正反应移动,故B错误;
C、单位时间内消耗H2和HI的物质的量之比等于1:2,处于平衡状态,大于1:2,说明氢气的消耗速率大于生成速率,反应未到达平衡状态,反应向正反应进行,故C正确;
D、恒温恒容充入He,反应混合气体各组分的浓度不变,平衡不移动,故D错误.
故选C.
B、增大压强平衡向体积减小的方向移动,即向正反应方向移动,NH3的体积分数增大.增大氨气的浓度平衡向逆反应移动,移动的结果是降低氨气浓度增大的趋势,平衡时仍比原来的浓度高,所以平衡不一定向正反应移动,故B错误;
C、单位时间内消耗H2和HI的物质的量之比等于1:2,处于平衡状态,大于1:2,说明氢气的消耗速率大于生成速率,反应未到达平衡状态,反应向正反应进行,故C正确;
D、恒温恒容充入He,反应混合气体各组分的浓度不变,平衡不移动,故D错误.
故选C.
点评:本题考查外界条件对化学平衡的影响,难度中等,注意惰性气体、压强的影响,同时可借助平衡常数进行判断.

练习册系列答案
相关题目
碳的多样性体现了物质世界的多样性.
(1)C、Si、N三种元素的电负性由大到小的顺序为 .
(2)2010年诺贝尔物理学奖所指向的是碳的又一张奇妙面孔;人类已知的最薄材料--石墨烯.
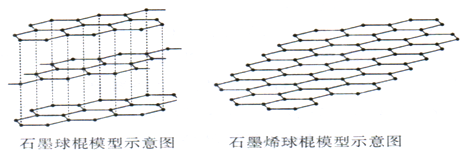
①下列说法中,正确的是 .(填标号)
A.碳各种单质的晶体类型相同 B.石墨烯含有非极性键
C.从石墨剥离得到石墨烯需要破坏化学键 D.石墨烯具有导电性
②石墨烯中,每个碳原子通过 杂化与周围碳原子成键,12g石墨烯含σ键数约为 .
③化学气相沉积法是获得石墨烯的有效方法之一,催化剂可以用金、铜等金属.根据下表数据,铜的第一电离能 (I1) 小于锌的第一电离能,试解释铜的第二电离能(I2)却大于锌的第二电离能的主要原因 .
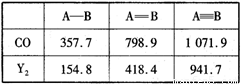
(3)CO与N2相似,分子中都存在一个共价叁键,CO分子中含 个π键.分析下表中的有关数据,说明CO 的化学性质比N2活泼的原因: .
(1)C、Si、N三种元素的电负性由大到小的顺序为
(2)2010年诺贝尔物理学奖所指向的是碳的又一张奇妙面孔;人类已知的最薄材料--石墨烯.

①下列说法中,正确的是
A.碳各种单质的晶体类型相同 B.石墨烯含有非极性键
C.从石墨剥离得到石墨烯需要破坏化学键 D.石墨烯具有导电性
②石墨烯中,每个碳原子通过
③化学气相沉积法是获得石墨烯的有效方法之一,催化剂可以用金、铜等金属.根据下表数据,铜的第一电离能 (I1) 小于锌的第一电离能,试解释铜的第二电离能(I2)却大于锌的第二电离能的主要原因
| 电离能/KJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| 化学键 | C-O | C=O | C≡O |
| 键能/KJ?mol-1 | 351 | 803 | 1071 |
| 化学键 | N-N | N=N | N≡N |
| 键能/KJ?mol-1 | 159 | 418 | 946 |
下列说法中正确的是( )
| A、SiO2既能溶于NaOH溶液又能溶于氢氟酸,说明SiO2是两性氧化物 | B、将Cu片置于浓H2SO4中,无明显现象,说明Cu在冷的浓硫酸中被钝化 | C、自来水厂可用明矾对水进行杀菌消毒 | D、常温下氨能与氯气反应生成氯化氢和氮气,因此可用浓氨水检查氯气管道中某处是否泄漏 |
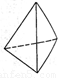
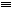 O,元素Y的单质Y2的结构也可表示为Y
O,元素Y的单质Y2的结构也可表示为Y