题目内容
 (11分)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- ==[AgCl2]-, 右图是某温度下AgCl在NaCl溶液中的溶解情况。
(11分)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- ==[AgCl2]-, 右图是某温度下AgCl在NaCl溶液中的溶解情况。
![]()
由以上信息可知:
![]()
(1)由图知该温度下AgCl的溶度积常数为 。
![]()
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
![]()
![]()
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是
![]()
![]()
(4)若在AgCl形成的浊液中滴加氨水有什么现象?
![]()
发生反应的离子方程式为 。
(1) 10―12 (2分)
(2)Cl-抑制了AgCl的溶解,但Cl-浓度增大使AgCl形成络合物:AgCl + Cl- ==[AgCl2]-(2分)
(3)向AgCl悬浊液中滴加KI稀溶液(0.1mol/L),固体由白色转化为黄色,再向悬浊液中滴加同浓度Na2S稀溶液(0.1mol/L),固体由黄色转化为黑色。(3分)
(4)白色沉淀溶解,形成无色溶液(2分);AgCl+2NH3=Ag(NH3)2++ Cl―(2分)

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2009?梅州模拟)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.
(2009?梅州模拟)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况. CO(g)+H2(g)△H=+131.3kJ?mol-1,
CO(g)+H2(g)△H=+131.3kJ?mol-1, 在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.
在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.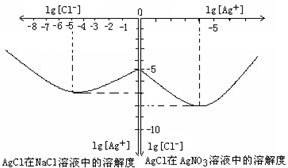
 沉淀物并非绝对不溶,其在水及各种不同的溶液中溶解有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.如图是AgCl在NaCl、AgNO3 溶液中的溶解情况.
沉淀物并非绝对不溶,其在水及各种不同的溶液中溶解有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.如图是AgCl在NaCl、AgNO3 溶液中的溶解情况.