题目内容
【题目】空气中CO2的含量及有效利用,已经引起各国的普遍重视
Ⅰ:目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.
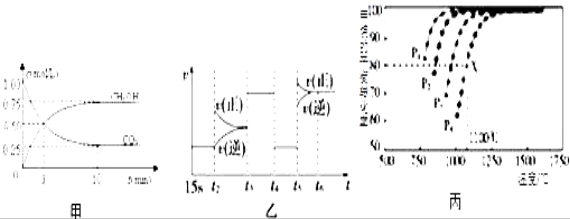
(1)前3min内,平均反应速率v(H2)=_________ _____.此温度下该反应的平衡常数为____________(保留两位小数).
(2)下列措施中,既能使反应加快,又能使![]() 增大的是___________.
增大的是___________.
A.升高温度 B.充入惰性气体 C.将H2O(g)从体系中分离 D.再充入1mol H2
(3)图乙中t5时引起平衡移动的条件是_____________.(填序号)
A.升高温度 B.增大反应物浓度 C.使用催化剂 D.增大体系压强
(4)反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,化学平衡____________(填“正向”、“逆向”或“不”)移动.
Ⅱ:利用CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)将CO2转化成燃料气.T℃时,在恒容密闭容器中通入物质的量均为0.1mol的CH4与CO2,发生上述反应,测得CH4的平衡转化率与温度及压强的关系如图所示,
2CO(g)+2H2(g)将CO2转化成燃料气.T℃时,在恒容密闭容器中通入物质的量均为0.1mol的CH4与CO2,发生上述反应,测得CH4的平衡转化率与温度及压强的关系如图所示,
(5)下列事实能说明该反应达到平衡的是_______________
a.CO的物质的量不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO2)=2v逆(H2)
d.混合气体压强不再发生变化
e.单位时间内生成n mol CH4的同时消耗2n mol H2
(6)据图可知P1、P2、P3、P4由小到大的顺序是__________________________.
【答案】
(1)0.5 molL-1min-1;5.33;
(2)D;(3)D;(4)正向;(5)ad;
(6)P1<P2<P3<P4;
【解析】
试题分析:(1) CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.5 1.5 0.5 0.5
3nim(mol/L):0.5 1.5 0.5 0.5
从反应开始到平衡,氢气的平均反应速率v(H2)=![]() =0.5 molL-1min-1,
=0.5 molL-1min-1,
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则
k=![]() =
=![]() =5.33,故答案为:0.5 molL-1min-1;5.33;
=5.33,故答案为:0.5 molL-1min-1;5.33;
(2)要使![]() 增大,应使平衡向正反应方向移动。A.因正反应放热,升高温度平衡向逆反应方向移动,则
增大,应使平衡向正反应方向移动。A.因正反应放热,升高温度平衡向逆反应方向移动,则![]() 减小,故A错误;B.充入惰性气体,使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,
减小,故A错误;B.充入惰性气体,使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,![]() 不变,故D错误.故B错误;C.将H2O(g)从体系中分离,生成物浓度减小,反应速率减小,平衡向正反应方向移动,
不变,故D错误.故B错误;C.将H2O(g)从体系中分离,生成物浓度减小,反应速率减小,平衡向正反应方向移动,![]() 增大,故C错误;D.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大反应速率增大,平衡向正反应方向移动,则
增大,故C错误;D.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大反应速率增大,平衡向正反应方向移动,则![]() 增大,故D正确;故答案为:D;
增大,故D正确;故答案为:D;
(3)t5时刻正逆反应速率都增大,且平衡正向进行。A.若是升高温度,反应是放热反应,升温平衡逆向进行,图象中反应速率变化不符合,故A错误;B.增大反应物浓度,正反应速率瞬间增大,此时逆反应速率不变,图象速率曲线不符合,故B错误;C.催化剂同等程度改变正逆反应速率,平衡不变,故C错误;D.增大压强平衡正向进行,正逆反应速率增大,故D正确;故答案为:D;
(4) CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
开始(mol/L): 1 3 0 0
变化(mol/L):0.75 2.25
平衡(mol/L):0.25 0.75 0.75 0.75
反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,计算浓度商Qc=![]() =0.46<K=5.33,反应正向进行,故答案为:正向;
=0.46<K=5.33,反应正向进行,故答案为:正向;
(5)a.CO的物质的量不再发生变化,说明达平衡状态,故a正确;b.混合气体的密度一直不发生变化,不一 定是平衡状态,故b错误;c.v正(CO2)=![]() v正(H2)=2v逆(H2),所以不是平衡状态,故c错误;d.混合气体压强不再发生变化,说明物质的量不变,达平衡状态,故d正确;e.单位时间内生成n mol CH4的同时消耗2nmolH2都反映的量逆向,未体现正与逆的关系,故e错误,故答案为:ad;
v正(H2)=2v逆(H2),所以不是平衡状态,故c错误;d.混合气体压强不再发生变化,说明物质的量不变,达平衡状态,故d正确;e.单位时间内生成n mol CH4的同时消耗2nmolH2都反映的量逆向,未体现正与逆的关系,故e错误,故答案为:ad;
(6)压强增大,平衡向逆反应方向移动,甲烷的转化率变小,故P4>P3>P2>P1,由小到大的顺序为P1<P2<P3<P4,故答案为:P1<P2<P3<P4。

【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
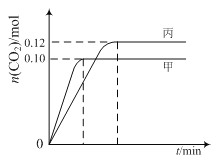
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)>v(逆)
D. T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%

