题目内容
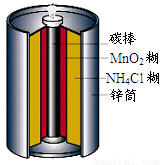
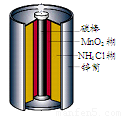
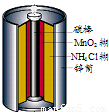
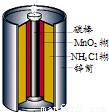
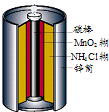 最早使用的化学电源是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解.一般认为,放电时,电池中的反应如图:
最早使用的化学电源是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解.一般认为,放电时,电池中的反应如图:E极:2MnO2+2H2O+2e-═2MnO(OH)+2OH-
F极:Zn+2NH4Cl-2e-═Zn(NH3)2Cl2+2H+
总反应式:2MnO2+Zn+2NH4Cl═2MnO(OH)+Zn(NH3)2Cl2
下列说法正确的是( )
分析:A、原电池的正极发生得电子的还原反应;
B、原电池的负极发生失去电子的氧化反应;
C、锌锰电池应属于一次电池;
D、一次电池内部发生的氧化还原反应是不可逆的.
B、原电池的负极发生失去电子的氧化反应;
C、锌锰电池应属于一次电池;
D、一次电池内部发生的氧化还原反应是不可逆的.
解答:解:A、原电池的E极发生的是得电子的还原反应,是正极反应,故A错误;
B、原电池的F极发生失去电子的氧化反应,F电极应该是负极,故B正确;
C、从结构上分析,锌锰电池应属于一次电池,故C错误;
D、锌锰电池应属于一次电池,一次电池内部发生的氧化还原反应是不可逆的,故D错误.
故选B.
B、原电池的F极发生失去电子的氧化反应,F电极应该是负极,故B正确;
C、从结构上分析,锌锰电池应属于一次电池,故C错误;
D、锌锰电池应属于一次电池,一次电池内部发生的氧化还原反应是不可逆的,故D错误.
故选B.
点评:本题考查学生一次电池锌锰电池的工作原理,可以根据所学知识来回答,属于教材知识的考查,难度不大.

练习册系列答案
相关题目