题目内容
【题目】地球上的元素大多数是金属,Na、Mg、Al是常见的主族金属元素,Fe和Cu是常见的过渡金属元素。它们在化学中占有极其重要的地位。
(1)①Na、Mg、Al三种元素第一电离能由大到小的顺序为___________
②金属钠原子的堆积方式是体心立方,其配位数为___________
(2)选修三课本第42页实验2-2:向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
①硫酸铜溶液中呈___________色的物质是水合铜离子,请写出它的结构简式,并标明其中配位键___________
②请写出难溶物溶解得到深蓝色的透明溶液的离子方程式___________
③结构测定的实验证明,无论在氨水溶液中还是在晶体中,深蓝色都是由于存在某种离子,1mol该离子含有___________molσ键。
(3)写出少量Na2O2与氯化铁溶液反应的离子反应方程式:___________(要求:仅写1个总的离子方程式)
【答案】Mg>Al>Na 8 天蓝 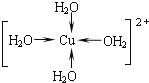 Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-或:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O 16 6Na2O2+6H2O+4Fe3+=4Fe(OH)3↓+12Na++3O2↑
Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-或:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O 16 6Na2O2+6H2O+4Fe3+=4Fe(OH)3↓+12Na++3O2↑
【解析】
(1)①Na、Mg、Al同周期,同周期自左而右元素的第一电离能呈增大趋势,但Mg最外层3s能级容纳2个电子,为全满确定状态,能量较低,第一电离能也高于同周期相邻元素;
②钠为体心立方堆积,钠晶胞中每个钠离子的配位数为8;
(2)①铜离子与水络合生成水合铜离子显蓝色,铜离子提供4个空轨道;
②依据离子反应方程式书写规则书写即可;
③依据结构式计算含有的共价键数;
(3)过氧化钠先与水反应生成氢氧化钠与氧气,氢氧化钠与铁离子生成氢氧化铁红褐色沉淀。
(1)①Na、Mg、Al同周期,同周期自左而右元素的第一电离能呈增大趋势,但Mg最外层3s能级容纳2个电子,为全满确定状态,能量较低,第一电离能也高于同周期相邻元素,故第一电离能Mg>Al>Na;
②钠为体心立方堆积,故钠晶胞中每个钠离子的配位数为8;
(2)①硫酸铜溶液中因为存在水合铜离子而使得溶液呈天蓝色,水合铜离子为:[Cu(H2O)4]2+,其中Cu2+与4个H2O中的氧原子形成配位键,其结构式为: ;
;
②氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-或:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O;
③深蓝色溶液中的阳离子为四氨合铜络离子:[Cu(NH3)4]2+,1mol[Cu(NH3)4]2+中存在4+12=16molσ键;
(3)过氧化钠与水反应生成氢氧化钠和氧气,其中氢氧化钠与铁离子又生成氢氧化铁沉淀,故离子反应方程式为:6Na2O2+6H2O+4Fe3+=4Fe(OH)3↓+12Na++3O2↑。