题目内容
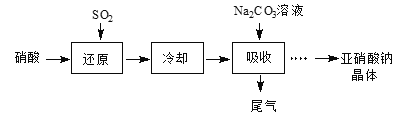
【题目】某课外兴趣小组通过如图所示的流程来制取少量亚硝酸钠晶体(NaNO2),并对其进行纯度测定和相关性质的实验。
已知:Ⅰ.Na2CO3 + NO + NO2 = 2NaNO2 + CO2;
Na2CO3 + 2NO2 = NaNO2 + NaNO3 + CO2
Ⅱ.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是________。此时SO2从底部通入,硝酸从顶部以雾状喷下,其目的是______。
(2)若使“吸收”步骤中NOX完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为_____。
(3)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取2.000 g样品,将其配成250 mL溶液。
b.先向锥形瓶内加入40.00 mL 0.100 mol·L-1的H2SO4溶液,加热至40~50℃。冷却后再向其中加入20.00 mL 0. 100 mol·L-1 KMnO4溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,重复三次,平均消耗样品溶液50.00 mL。(NaNO2与KMnO4反应的关系式为:2KMnO4~5NaNO2)
①整个测定过程中应迅速操作,不宜耗时过长,否则样品的纯度____(“偏大”、“偏小”或“无影响”),原因是_______。
②通过计算,该样品中NaNO2的质量分数是_____,可能含有的杂质有________(写出其中两种)。
(4)该课外兴趣小组将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,该反应的离子方程式是____。
【答案】N(氮) 气液逆向吸收,使硝酸与SO2充分反应 1∶1 偏小 NaNO2被空气中的氧气氧化 86.25% Na2CO3、NaHCO3、NaNO3(写出两种即可) 2NO2- + 4H+ + 2I- = 2NO↑ + I2 + 2H2O
【解析】
硝酸中通入二氧化硫发生氧化还原反应,冷却后生成的气体用碳酸钠溶液吸收生成亚硝酸钠和二氧化碳,蒸发结晶得到亚硝酸钠晶体,
![]() 硝酸溶液中通入二氧化硫被还原,SO2从底部通入,硝酸从顶部以雾状喷下增大硝酸和二氧化硫接触面积使之充分反应;
硝酸溶液中通入二氧化硫被还原,SO2从底部通入,硝酸从顶部以雾状喷下增大硝酸和二氧化硫接触面积使之充分反应;
![]() 若使“吸收”步骤中NOx完全转化为NaNO2,发生反应Na2CO3+NO+NO2 = 2NaNO2 + CO2,二氧化硫和硝酸反应生成NO和NO2物质的量之比为1:1,结合电子守恒计算得到SO2与HNO3的物质的量之比;
若使“吸收”步骤中NOx完全转化为NaNO2,发生反应Na2CO3+NO+NO2 = 2NaNO2 + CO2,二氧化硫和硝酸反应生成NO和NO2物质的量之比为1:1,结合电子守恒计算得到SO2与HNO3的物质的量之比;
![]() ①亚硝酸钠已被空气中氧气氧化,导致测定产生误差;
①亚硝酸钠已被空气中氧气氧化,导致测定产生误差;
②NaNO2与KMnO4反应的关系式为:2KMnO4~5NaNO2,计算亚硝酸钠物质的量,计算含量,注意溶液体积的变化,乙酸钠吸收二氧化氮、一氧化氮,可能含杂质是被氧化生成的硝酸钠、剩余的碳酸钠或反应生成的碳酸氢钠;
![]() 将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,说明亚硝酸根离子氧化碘离子生成碘单质,以此分析解答。
将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,说明亚硝酸根离子氧化碘离子生成碘单质,以此分析解答。
![]() 硝酸溶液中通入二氧化硫被还原,“还原”步骤中被还原的元素是N元素,SO2从底部通入,硝酸从顶部以雾状喷下增大硝酸和二氧化硫接触面积使之充分反应,气液逆向吸收,使硝酸与SO2充分反应,
硝酸溶液中通入二氧化硫被还原,“还原”步骤中被还原的元素是N元素,SO2从底部通入,硝酸从顶部以雾状喷下增大硝酸和二氧化硫接触面积使之充分反应,气液逆向吸收,使硝酸与SO2充分反应,
故答案为:N;气液逆向吸收,使硝酸与SO2充分反应;
![]() 若使“吸收”步骤中NOx完全转化为NaNO2,发生反应Na2CO3+NO+NO2 = 2NaNO2 + CO2,二氧化硫和硝酸反应生成NO和NO2物质的量之比为1:1,
若使“吸收”步骤中NOx完全转化为NaNO2,发生反应Na2CO3+NO+NO2 = 2NaNO2 + CO2,二氧化硫和硝酸反应生成NO和NO2物质的量之比为1:1,![]() ,
,![]() ,1molHNO3反应生成0.5molNO和0.5molNO2,电子转移总数(1×
,1molHNO3反应生成0.5molNO和0.5molNO2,电子转移总数(1×![]() ×3e-+1×
×3e-+1×![]() ×e-)=2e-,SO2~H2SO4~2e-,结合电子守恒计算得到SO2与HNO3的物质的量之比=1:1,
×e-)=2e-,SO2~H2SO4~2e-,结合电子守恒计算得到SO2与HNO3的物质的量之比=1:1,
故答案为:1:1;
![]() ①整个测定过程中应迅速操作,不宜耗时过长,若时间过长NaNO2被空气中的氧气氧化,则样品的纯度测定偏小,
①整个测定过程中应迅速操作,不宜耗时过长,若时间过长NaNO2被空气中的氧气氧化,则样品的纯度测定偏小,
故答案为:偏小;NaNO2被空气中的氧气氧化;
②![]() ,
,
2 5
0.020L×0.1mol/L n
n=0.005mol,
250mL溶液中含亚硝酸钠物质的量=0.005mol×![]() =0.25mol,
=0.25mol,
该样品中NaNO2的质量分数![]() ,
,
亚硝酸钠制备过程分析可知:可能含杂质是被氧化生成的硝酸钠、剩余的碳酸钠或反应生成的碳酸氢钠,化学式为:Na2CO3、NaHCO3、NaNO3,
故答案为:86.25%;Na2CO3、NaHCO3、NaNO3;
![]() 将
将![]() 溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,说明亚硝酸根离子氧化碘离子生成碘单质,反应的离子方程式为:2NO2-+ 4H+ + 2I-= 2NO↑ + I2 + 2H2O,
溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,说明亚硝酸根离子氧化碘离子生成碘单质,反应的离子方程式为:2NO2-+ 4H+ + 2I-= 2NO↑ + I2 + 2H2O,
故答案为:2NO2-+ 4H+ + 2I-= 2NO↑ + I2 + 2H2O。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案