题目内容
常温下Ca(OH)2溶于水达饱和时存在如下平衡: Ca(OH)2(s)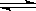 Ca(OH)2(aq),
Ca(OH)2(aq),
Ca(OH)2(aq)==Ca2++2OH— 饱和石灰水的密度为d g/cm3,溶液的pH=12。则该温度下Ca(OH)2的溶解度为 ( )
A. B.
B. C.
C. D.
D.
【答案】
A
【解析】根据题意可知100ml溶液中的OH-物质的量是0.1L×0.01mol/L=0.001mol,则溶解的氢氧化钙是0.001mol÷2=0.0005mol,质量是0.0005mol×74g/mol=0.037g。溶液中含有的溶剂质量是(100d-0.037)g,所以溶解度是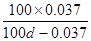 ,所以A正确。答案选A。
,所以A正确。答案选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 Ca(OH)2(aq),Ca(OH)2(aq)
Ca(OH)2(aq),Ca(OH)2(aq) B.
B. C.
C. D.
D.