题目内容
将a mol 铜加入到一定浓度的硝酸溶液中,充分反应后,铜完全溶解并产生气体(不考虑N2 O4 ).试回答下列问题:
(1)硝酸在该反应中表现的性质为
(2)当a=0.2 时,则反应中转移的电子数为
(3)用NH3吸收硝酸生产中产生的尾气是一种较为先进的处理方法,其产物是参与大气循环的物质,对环境无污染,目前在工业生产中已被广泛应用.试写出用NH3恰好吸收(2)所产生气体的总化学方程式
(1)硝酸在该反应中表现的性质为
氧化性、酸性
氧化性、酸性
.(2)当a=0.2 时,则反应中转移的电子数为
0.4
0.4
mol,若此时收集到的气体在标准状况下的体积为4.48L,则该气体为NO、NO2
NO、NO2
.(3)用NH3吸收硝酸生产中产生的尾气是一种较为先进的处理方法,其产物是参与大气循环的物质,对环境无污染,目前在工业生产中已被广泛应用.试写出用NH3恰好吸收(2)所产生气体的总化学方程式
NO+NO2+2NH3=2N2+3H2O
NO+NO2+2NH3=2N2+3H2O
.分析:(1)根据元素的化合价是否变化判断;
(2)根据得失电子数相等判断气体的成分;
(3)利用十字相乘法推断一氧化氮和二氧化氮的物质的量之比,再结合题意判断生成物,从而写出反应方程式.
(2)根据得失电子数相等判断气体的成分;
(3)利用十字相乘法推断一氧化氮和二氧化氮的物质的量之比,再结合题意判断生成物,从而写出反应方程式.
解答:解:(1)铜与硝酸溶液反应,硝酸在该反应中部分化合价没变化,部分得电子作氧化剂,所以硝酸表现的性质为酸性和氧化性.
故答案为:酸性、氧化性;
(2)反应中转移的电子数为铜失去的电子数,当a=0.2 时,铜失去的电子数为:0.2mol×2=0.4mol;
生成气体在标准状况下的物质的量为:
=0.2mol,
若只生成NO2气体,令生成的物质的量为x,根据电子转移守恒,则:
(5-4)×x=0.4mol,解得:x=0.4mol
若只生成NO气体,令生成的物质的量为y,根据电子转移守恒,则:
(5-2)×y=0.4mol,解得:y=
mol
由于
mol<0.2mol<0.4mol,所以,气体为 NO、NO2 混合物.
故答案为:0.4mol;NO、NO2;
(3)利用十字交叉法求NO、NO2 物质的量之比
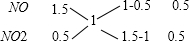
所以,NO、NO2 物质的量之比为0.5:0.5=1:1
产物是参与大气循环的物质,对环境无污染,所以产物2N2和H2O,总化学方程式为:NO+NO2+2NH3=2N2+3H2O,
故答案为:NO+NO2+2NH3=2N2+3H2O.
故答案为:酸性、氧化性;
(2)反应中转移的电子数为铜失去的电子数,当a=0.2 时,铜失去的电子数为:0.2mol×2=0.4mol;
生成气体在标准状况下的物质的量为:
| 4.48L |
| 22.4L/mol |
若只生成NO2气体,令生成的物质的量为x,根据电子转移守恒,则:
(5-4)×x=0.4mol,解得:x=0.4mol
若只生成NO气体,令生成的物质的量为y,根据电子转移守恒,则:
(5-2)×y=0.4mol,解得:y=
| 2 |
| 15 |
由于
| 2 |
| 15 |
故答案为:0.4mol;NO、NO2;
(3)利用十字交叉法求NO、NO2 物质的量之比

所以,NO、NO2 物质的量之比为0.5:0.5=1:1
产物是参与大气循环的物质,对环境无污染,所以产物2N2和H2O,总化学方程式为:NO+NO2+2NH3=2N2+3H2O,
故答案为:NO+NO2+2NH3=2N2+3H2O.
点评:本题以硝酸的化学性质为载体考查了化学方程式的书写及物质的量的有关计算,难度不大,明确二氧化氮和一氧化氮的物质的量之间的关系是解(3)题的关键.

练习册系列答案
相关题目