题目内容
【题目】现有如下各说法:
①在水中氢、氧原子间的作用力只有共价键。
②金属和非金属化合形成离子键。
③离子键是阳离子、阴离子的相互吸引。
④根据电离方程式HCl=H++Cl-,判断HCl分子里存在离子键。
上述各种说法正确的是( )
A.①②正确B.都不正确
C.④正确,其他不正确D.仅①不正确
【答案】B
【解析】
①在水中氢、氧原子间还存在氢键,故①错误;
②金属元素和非金属元素化合可能形成离子键也可能形成共价键,如氯化铝,故②错误;
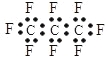
③离子键是阳离子、阴离子的相互作用形成的,相互作用包含吸引力和排斥力,故③错误;④![]() 为共价化合物,只含共价键,HCl是强电解质,在溶液中在水的作用下发生电离,电离出氢离子和氯离子,不含有离子键,故④错误;
为共价化合物,只含共价键,HCl是强电解质,在溶液中在水的作用下发生电离,电离出氢离子和氯离子,不含有离子键,故④错误;
因为都不正确,答案选B。

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
【题目】常温下,有关物质的溶度积如下
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
下列有关说法不正确的是( )
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg 2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg 2+)∶c(Fe3+)=2 .125×1021
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.054×10-2mol/L],若保持温度不变, 向其中加入100mL 0.012mol/L的NaOH,则该溶液变为不饱和溶液。