题目内容
SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一。
(1)在接触法制硫酸的过程中,发生2SO2(g)+O2(g)
 2SO3(g)
△H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
2SO3(g)
△H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:

①平衡状态由A到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”);
②将2.0molSO2和1.0molO2置于10L的密闭容器中,若40s后反应达到平衡,此时体系总压强为0.10MPa,这一段时间内SO2的平均反应速率为 。
该反应的平衡常数为 。
(2)用CH4催化还原NOx可消除氮的氧化物的污染,例如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H=—574kJ·mol—1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H=—1160kJ·mol—1
取标准状况下4.48LCH4并使之完全反应:
①若将NO2还原至N2,整个过程中转移电子的物质的量为 ;
②若还原NO2和NO的混合物,放出的总热量Q的取值范围是 。
(1)①=;(1分)②0.0040mol·L—1·s—1,800L·mol—1;(共4分,各2分,无单位或错误扣1分)
(2)①1.6mol(2分,无单位扣1分)②173.4kJ<Q<232kJ(3分)
【解析】
试题分析:⑴①平衡状态由A变到B时,改变的是压强,平衡常数只受温度影响,温度不变,平衡常数不变,故平衡常数K(A)=K(B),故答案为:=;②反应达平衡后,体系总压强为0.10MPa,由图可知,SO2的平衡转化率α=0.80,参加反应的二氧化硫为2mol×80%=1.6mol,这一段时间内SO2的平均反应速率为 =0.0040mol·L—1·s—1
=0.0040mol·L—1·s—1
则:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
开始(mol):2 1 0
变化(mol):1.6 0.8 1.6
平衡(mol):0.4 0.2 1.6
所以平衡时浓度:c(SO2)=0.04mol·L-1,c(O2)=0.02mol·L-1,c(SO3)=0.16mol·L-1,故平衡常数k=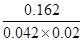 =800,故答案为:0.0040mol·L—1·s—1,800;
=800,故答案为:0.0040mol·L—1·s—1,800;
⑵①利用盖斯定律,将题中反应相加后除以2得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ·mol-1.每1molCH4转移8mol电子,现标准状况下4.48LCH4即0.2mol,转移电子数为1.6mol;②由极值法,若还原NO2放热867kJ×0.2=173.4kJ:若还原NO放热1160kJ×0.2=232kJ,放出的总热量Q的取值范围是173.4kJ<Q<232kJ。
考点:化学平衡的计算;化学平衡常数的含义;化学平衡状态的判断,化学能与热能的相互转化

 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.