题目内容
已知X、M都是中学教材常见元素.下列对两个离子反应通式的推断中,其中正确的是( )
(甲)XO3n+Xn+H+--X单质+H2O(未配平);(乙)Mm++mOH-→M(OH)m↓
①若n=1,则XO3n中X元素为+5价,X位于周期表第VA族
②若n=2.则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m.
(甲)XO3n+Xn+H+--X单质+H2O(未配平);(乙)Mm++mOH-→M(OH)m↓
①若n=1,则XO3n中X元素为+5价,X位于周期表第VA族
②若n=2.则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m.
分析:①n=1,XO3n中X元素为+5价,常见非金属元素中呈+5价的元素有第ⅤA族(氮、磷)、第ⅤⅡA族(氯、溴、碘)所以符合条件的酸根阴离子主要有:IO3-、ClO3-、BrO3-、NO3-,甲反应为ClO3-+5Cl-+6H+=3Cl2+3H2O,IO3-+5I-+6H+=3I2+3H2O;
②n=2,XO3n中X元素为+4价,常见非金属元素中碳、硅、硫有+4价,结合通式只有X为硫符合题意,离子方程式为:SO32-+2S2-+6H+=3S↓+3H2O,硫的最高价含氧酸为硫酸,氢化物为硫化氢;
③m=1,+1价阳离子有:Ag+、Na+、K+等,只有氢氧化银是难溶于水的沉淀;Ag++OH-=AgOH↓;氢氧化银溶于氨水,硝酸银溶液滴入氨水,生成银氨溶液无明显现象;将氨水滴入硝酸银溶液中 产生沉淀,继续滴加沉淀溶解,互滴顺序不同现象不同;
④m=2,硫酸亚铁中+2价铁在空气中易被氧化为+3价,其化学方程式为:FeSO4+2H2O?Fe(OH)2+3H2O;4Fe(OH)2+O2+2H2O=4Fe(OH)3,2Fe(OH)3
Fe2O3+3H2O Fe2O3+3H2SO4=Fe(SO4)3+3H2O 总反应为:12FeSO4+3O2
2Fe2O3+4Fe2(SO4)3,即硫酸亚铁溶液经蒸干、灼烧得到硫酸铁和氢氧化铁混合物;
⑤m=3,常见金属中只有铁、铝符合条件.
②n=2,XO3n中X元素为+4价,常见非金属元素中碳、硅、硫有+4价,结合通式只有X为硫符合题意,离子方程式为:SO32-+2S2-+6H+=3S↓+3H2O,硫的最高价含氧酸为硫酸,氢化物为硫化氢;
③m=1,+1价阳离子有:Ag+、Na+、K+等,只有氢氧化银是难溶于水的沉淀;Ag++OH-=AgOH↓;氢氧化银溶于氨水,硝酸银溶液滴入氨水,生成银氨溶液无明显现象;将氨水滴入硝酸银溶液中 产生沉淀,继续滴加沉淀溶解,互滴顺序不同现象不同;
④m=2,硫酸亚铁中+2价铁在空气中易被氧化为+3价,其化学方程式为:FeSO4+2H2O?Fe(OH)2+3H2O;4Fe(OH)2+O2+2H2O=4Fe(OH)3,2Fe(OH)3
| ||
| ||
⑤m=3,常见金属中只有铁、铝符合条件.
解答:解:①n=1,XO3n中X元素为+5价,常见非金属元素中呈+5价的元素有第ⅤA族(氮、磷)、第ⅤⅡA族(氯、溴、碘)所以符合条件的酸根阴离子主要有:IO3-、ClO3-、BrO3-、NO3-,甲反应为ClO3-+5Cl-+6H+=3Cl2+3H2O,IO3-+5I-+6H+=3I2+3H2O,故①错误;
②n=2,XO3n中X元素为+4价,常见非金属元素中碳、硅、硫有+4价,结合通式只有X为硫符合题意,离子方程式为:SO32-+2S2-+6H+=3S↓+3H2O,硫的最高价含氧酸为硫酸,氢化物为硫化氢,故②正确;
③m=1,+1价阳离子有:Ag+、Na+、K+等,只有氢氧化银是难溶于水的沉淀;Ag++OH-=AgOH↓;氢氧化银溶于氨水,硝酸银溶液滴入氨水,生成银氨溶液无明显现象;将氨水滴入硝酸银溶液中 产生沉淀,继续滴加沉淀溶解,互滴顺序不同现象不同,故③正确;
④m=2,硫酸亚铁中+2价铁在空气中易被氧化为+3价,其化学方程式为:FeSO4+2H2O?Fe(OH)2+3H2O;4Fe(OH)2+O2+2H2O=4Fe(OH)3,2Fe(OH)3
Fe2O3+3H2O Fe2O3+3H2SO4=Fe(SO4)3+3H2O 总反应为:12FeSO4+3O2
2Fe2O3+4Fe2(SO4)3,即硫酸亚铁溶液经蒸干、灼烧得到硫酸铁和氢氧化铁混合物,故④错误;
⑤m=3,常见金属中只有铁、铝符合条件,铝和过量氢氧化钠沉淀会溶解,故⑤错误;
故选D.
②n=2,XO3n中X元素为+4价,常见非金属元素中碳、硅、硫有+4价,结合通式只有X为硫符合题意,离子方程式为:SO32-+2S2-+6H+=3S↓+3H2O,硫的最高价含氧酸为硫酸,氢化物为硫化氢,故②正确;
③m=1,+1价阳离子有:Ag+、Na+、K+等,只有氢氧化银是难溶于水的沉淀;Ag++OH-=AgOH↓;氢氧化银溶于氨水,硝酸银溶液滴入氨水,生成银氨溶液无明显现象;将氨水滴入硝酸银溶液中 产生沉淀,继续滴加沉淀溶解,互滴顺序不同现象不同,故③正确;
④m=2,硫酸亚铁中+2价铁在空气中易被氧化为+3价,其化学方程式为:FeSO4+2H2O?Fe(OH)2+3H2O;4Fe(OH)2+O2+2H2O=4Fe(OH)3,2Fe(OH)3
| ||
| ||
⑤m=3,常见金属中只有铁、铝符合条件,铝和过量氢氧化钠沉淀会溶解,故⑤错误;
故选D.
点评:不同考查了常见物质的性质应用,物质发生反应的特征应用,分析化合价的变化和特征是解题关键.

练习册系列答案
相关题目
 +Xn
+Xn ——X单质
——X单质 未配平); (乙
未配平); (乙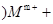 mOH-===M(OH)m
mOH-===M(OH)m
 溶液一定能得到
溶液一定能得到 与足量氢氧化钠溶液反应一定生成M(OH)m
与足量氢氧化钠溶液反应一定生成M(OH)m