题目内容
设NA 表示阿伏加德罗常数,下列叙述中正确的是
①31g白磷含有的P—P键数为NA ② 1molCH3+(碳正离子)中含有电子数为10NA ③1mol铜与足量硫蒸气反应,转移电子数为2NA ④用惰性电极电解CuCl2溶液,阴极析出32g铜时,线路中通过的电子数为NA ⑤0.84 g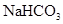 晶体中阳离子和阴离子总数为0.03NA ⑥3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA ⑦标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA
晶体中阳离子和阴离子总数为0.03NA ⑥3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA ⑦标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA
①31g白磷含有的P—P键数为NA ② 1molCH3+(碳正离子)中含有电子数为10NA ③1mol铜与足量硫蒸气反应,转移电子数为2NA ④用惰性电极电解CuCl2溶液,阴极析出32g铜时,线路中通过的电子数为NA ⑤0.84 g
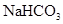 晶体中阳离子和阴离子总数为0.03NA ⑥3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA ⑦标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA
晶体中阳离子和阴离子总数为0.03NA ⑥3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA ⑦标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA | A.①②④ | B.④⑥ | C.③④⑤ | D.④⑥⑦ |
B
试题分析:①白磷化学式P4,每摩尔的白磷中含有6NA的P—P键,n(P4)=m/M=31g÷124g/mol=0.25mol.故含有的P—P键为0.25 mol.×6=1.5NA。错误。每个CH3+(碳正离子)中含有电子数为8个,所以1molCH3+(碳正离子)中含有电子数为8NA.错误。③发生反应:2Cu+S
 Cu2S,所以1mol铜与足量硫蒸气反应,转移电子数为NA。错误。 ④用惰性电极电解CuCl2溶液,反应方程式为:CuCl2
Cu2S,所以1mol铜与足量硫蒸气反应,转移电子数为NA。错误。 ④用惰性电极电解CuCl2溶液,反应方程式为:CuCl2 Cu+Cl2.↑由方程式可看出,若转移电子2 NA,阴极析出铜1mol,即64g,。现在,线路中通过的电子数为NA,所以产生Cu32g.正确。 ⑤NaHCO3=Na++HCO3-。每摩尔的盐中含有2 NA个离子。n(NaHCO3)="m/M=0.84" g÷84g/mol=0.01mol.故晶体中阳离子和阴离子总数为0.02NA。错误。 ⑥Na2O2和CO2反应的方程式为:2Na2O2+2CO2= Na2CO3+O2.每摩尔的Na2O2反应,转移电子1mol.n(Na2O2)=" m/M=3.9g÷78g/mol=0.05mol" .所以转移的电子数是0.05NA 正确。⑦铜与足量的浓硝酸反应的方程式为:Cu+4HNO3(浓)= Cu(NO3)2+ 2NO2↑+2H2O. 2NO2
Cu+Cl2.↑由方程式可看出,若转移电子2 NA,阴极析出铜1mol,即64g,。现在,线路中通过的电子数为NA,所以产生Cu32g.正确。 ⑤NaHCO3=Na++HCO3-。每摩尔的盐中含有2 NA个离子。n(NaHCO3)="m/M=0.84" g÷84g/mol=0.01mol.故晶体中阳离子和阴离子总数为0.02NA。错误。 ⑥Na2O2和CO2反应的方程式为:2Na2O2+2CO2= Na2CO3+O2.每摩尔的Na2O2反应,转移电子1mol.n(Na2O2)=" m/M=3.9g÷78g/mol=0.05mol" .所以转移的电子数是0.05NA 正确。⑦铜与足量的浓硝酸反应的方程式为:Cu+4HNO3(浓)= Cu(NO3)2+ 2NO2↑+2H2O. 2NO2 N2O4.n(Cu) ="m/M=3.2g÷64g/mol=0.05mol" .3.2g铜与足量的浓硝酸反应生成的气体含有的分子数少于0.1NA。错误。
N2O4.n(Cu) ="m/M=3.2g÷64g/mol=0.05mol" .3.2g铜与足量的浓硝酸反应生成的气体含有的分子数少于0.1NA。错误。
练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目