题目内容
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
| A.元素Y的最高正化合价为+6 |
| B.离子半径的大小顺序为W>Q>Z>X>Y |
| C.氢化物的沸点Y>W |
| D.元素W的最高价氧化物对应水化物的酸性比Q的强 |
C
解析试题分析:X的气态氢化物极易溶于Y的氢化物中,联想NH3极易溶于水,可知X为氮元素,Y为氧元素;常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液,说明Z为铝元素,W为硫元素,因为铝在常温下能溶于稀硫酸,在浓硫酸中发生钝化;Q只能为氯元素。
A、Y为氧元素,氧元素不显+6价,错误;B、离子半径大小顺序为Q>W>X>Y>Z,即Cl–>S2–>N3–>O2–>Al3+,错误;C、由于水分子间存在氢键,而H2S分子间只存在普通的分子间作用力,所以H2O的沸点高于H2S,即氢化物的沸点Y>W,正确;D、盐酸酸性比氢硫酸酸性强,错误。
考点:考查元素周期律、结构位置性质关系。

练习册系列答案
相关题目
下列有关物质结构和性质的说法中,正确的是( )
| A.因为水溶液的酸性:HCl>H2S,所以非金属性:Cl>S |
| B.同周期第ⅡA族与第IIIA族的元素原子序数之差不一定为1 |
| C.元素原子的最外层电子数越多,越容易得电子,非金属性越强 |
| D.同周期主族元素的原子形成的简单离子电子层结构相同 |
下列关于粒子结构的描述不正确的是( )
| A.H2S和NH3均是价电子总数为8的极性分子 |
| B.HS-和HCl均是含有一个极性键的18电子粒子 |
| C.CH2Cl2和CCl4均是四面体构型的非极性分子 |
D.1 mol 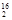 DO中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值) DO中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值) |
下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是
| A.半导体材料砷化镓 | B.透明陶瓷材料硒化锌 |
| C.吸氢材料镧镍合金 | D.超导材料K3C60 |
下列说法正确的是 ( )
A.Na的结构示意图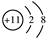 |
| B.多电子原子中,在离核较远区域运动的电子能量较低 |
| C.非金属元素组成的化合物中可能有共价键和离子键 |
| D.HF、HCl、HBr、HI的热稳定性和还原性依次增强 |
短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
| | R | | |
| T | Q | | W |
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含T的盐溶液一定显酸性
