题目内容
6.2molSO3和3molSO2其分子数之比为2:3;相同状况下(均为气体)体积之比为2:3;氧原子数之比为1:1.分析 由N=nNA可知,分子数目之比等于其物质的量之比,由V=nVm可知,相同条件下,气体体积之比等于其物质的量之比,结合分子式计算含有氧原子数目之比.
解答 解:由N=nNA可知,2molSO3和3molSO2其分子数之比为2mol:3mol=2:3,由V=nVm可知,相同条件下,2molSO3和3molSO2的体积之比为2mol:3mol=2:3,二者含有氧原子数目之比为2mol×3:3mol×2=1:1,
故答案为:2:3;2:3;1:1.
点评 本题考查物质的量有关计算,侧重微粒数目计算,注意对公式的理解与灵活应用,比较基础.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
17.下列混合物分离(或除杂)的方法不正确的是( )
| A. | 用CCl4可以从碘水中萃取碘 | |
| B. | Fe2O3中含有少量Al2O3可加入适量的NaOH除去 | |
| C. | Na2CO3固体中含有少量NaHCO3杂质可用加热的方法提纯 | |
| D. | Fe(NO3)3中混有少量Fe(NO3)2的杂质可加入适量的铁粉除去 |
14.金属在人类社会的发展进程中起着重要的作用.下列有关金属及其化合物的说法不正确的是( )
| A. | Fe、Mg、Al均能与空气中的氧气反应在表面生成致密的氧化膜,对内层金属有保护作用 | |
| B. | Fe在高温下能与水蒸气反应,Fe被氧化生成Fe3O4,H2O被还原生成H2 | |
| C. | 小苏打、氢氧化铝都可以用于中和胃酸 | |
| D. | 铝制餐具不适合长时间的蒸煮或长时间存放酸性、碱性或咸的食物 |
11.根据题意回答下列问题
(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol.
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是408.875kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
(II)某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55mol•L-1,盐酸的浓度为0.5mol•L-1,每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
(1)已知盐酸、NaOH溶液密度近似为1.00g•cm-3,中和后混合液的比热容c═4.18×10-3 kJ•g-1•℃-1,则该反应的中和热为△H=55.16.
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏小(填“偏大”、“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收能量,造成放出的能量偏小,所以测得的△H偏大,中和热偏小.
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热偏小(填“偏大”、“偏小”或“不变”).
(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol.
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是408.875kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
(II)某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55mol•L-1,盐酸的浓度为0.5mol•L-1,每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
| 3 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏小(填“偏大”、“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收能量,造成放出的能量偏小,所以测得的△H偏大,中和热偏小.
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热偏小(填“偏大”、“偏小”或“不变”).
18.用惰性电极电解饱和食盐水,如果阴极附近产生了8g的气体,则阳极产生的气体在标准状况下的体积是( )
| A. | 22.4L | B. | 44.8L | C. | 89.6L | D. | 1120L |


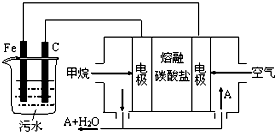 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.