题目内容
实验中常用Na2CO3溶液、NaOH溶液、BaCl2溶液作为除杂试剂除去粗盐中含有的泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质。下列除杂试剂添加顺序不合理的是
| A.NaOH溶液→BaCl2溶液→Na2CO3溶液 |
| B.BaCl2溶液→NaOH溶液→Na2CO3溶液 |
| C.BaCl2溶液→Na2CO3溶液→NaOH溶液 |
| D.Na2CO3溶液→BaCl2溶液→NaOH溶液 |
D
解析试题分析:除杂不引杂,引入的杂质还要除去,所以碳酸钠应放在氯化钡的后面把多余的钡离子除去,因此D错误。
考点:考查实验的具体操作和注意事项等问题。

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
下列实验操作不正确的是( )
| A.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体时即停止加热 |
| B.除去Fe(OH)3胶体中混有的Cl?离子,可用渗析的方法 |
| C.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| D.用四氯化碳萃取碘时,碘的四氯化碳溶液从分液漏斗上口倒出 |
通过加入过量的化学药品,采用恰当的分离混合物的方法,除去某溶液里溶解着的杂质,下列做法中正确的是
| A.NaCl溶液(BaCl2):加K2SO4溶液,过滤 |
| B.KNO3溶液(AgNO3):加NaCl溶液,过滤 |
| C.NaCl溶液(I2):加酒精,分液 |
| D.KNO3溶液(I2):加四氯化碳,萃取 |
下列实验操作、现象和解释都正确的是
| 选项 | 实验操作 | 现象 | 解释 |
| A. | 向某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO32? |
| B. | 新制Fe(OH)2露置于空气中一段时间 | 白色固体迅速变为灰绿色,最终变为红褐色 | 说明Fe(OH)2易被氧化成Fe(OH)3 |
| C. | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀生产,苯层呈紫色 | 白色沉淀可能为CuI |
| D. | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有SO42- |
为除去下表物质中的杂质(括号内为杂质),所选试剂(过量)及操作方法均正确的是
| | 物质 | 选用试剂(过量) | 操作方法 |
| A | Cu(CuO) | 氧气 | 通入氧气并加热 |
| B | CO2(HCl) | 饱和碳酸氢纳溶液 | 通过盛有饱和碳酸氢纳溶液的洗气瓶 |
| C | CO(H2) | 氧化铜 | 通过灼热的氧化铜 |
| D | KCl溶液(K2CO3) | 氯化钙溶液 | 加入氯化钙溶液充分反应后过滤 |
除去NaCl中混有的 MgCl2、Na2SO4时选用试剂依次为( )
| A.NaOH、BaCl2、Na2CO3、HCl |
| B.Ca(OH) 2、Mg(NO3) 2、Na2CO3、HCl |
| C.NaOH、Ba(NO3) 2、Na2CO3、HCl |
| D.Na2CO3、BaCl2、HCl |
下列的分离方法不正确的是( )
| A.用酒精萃取碘水中的碘 |
| B.用过滤的方法除去食盐水中的泥沙 |
| C.用蒸馏的方法将自来水制成蒸馏水 |
| D.用渗析的方法除去淀粉胶体中含有的少量NaCl |
根据下图海水综合利用的工业流程图,判断下列说法正确的是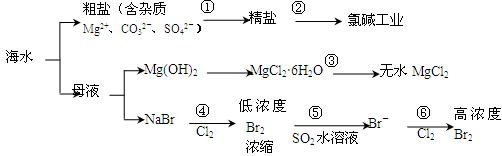
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
| A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 |
| B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2. 24 L Cl2 |
| D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |