题目内容
9.卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若以它为原料按如图所示工艺流程进行生产,可制得轻质氧化镁.
若要求产品尽量不含杂质,而且生产成本较低,根据以下资料,填写空白:
已知:(1)25°C,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16,
Ksp[Mg(OH)2]=1.8×10-11,Ksp[Mn(OH)2]=4.0×10-14,
(2)Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去
(3)原料价格表
| 物质 | 价格/元?吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
(2)在步骤②中加入的试剂X,最佳的选择是漂液(NaClO)
(3)在步骤③中加入的试剂Y应是烧碱(NaOH),步骤⑤中发生的反应是MgCO3+H2O$\frac{\underline{\;煮沸\;}}{\;}$Mg(OH)2+CO2↑
(4)步骤⑥如在实验室进行,应选用在坩埚(填仪器名称)中灼烧.
(5)25℃,往卤块对应的水溶液中,加入一定量的烧碱达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=4×10-8mol/L.
分析 为除去Fe2+,先将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,然后在滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,然后加热煮沸可得到Mg(OH)2,灼烧后得到MgO.
(1)根据Fe3+的检验方法可知,Fe3+遇KSCN溶液时溶液为血红色,以此来检验;
(2)依据图表数据和经济效益分析加入的试剂的最佳选择;
(3)在步骤③中加入的试剂Y目的是调节pH,选用氢氧化钠;步骤④生成沉淀为碳酸镁,步骤⑤中碳酸镁在加热条件下水解生成氢氧化镁和二氧化碳气体;
(4)步骤⑥为灼烧氢氧化镁制取氧化镁,应在坩埚中进行;
(5)pH=4.0,c(H+)=0.0001mol/L,求出水的常数积计算出氢氧根离子的浓度,25℃时,Fe(OH)3的溶度积常数Ksp=4.0×10-38,由Fe(OH)3的电离平衡常数以此计算.
解答 解:(1)KSCN与Fe3+作用使溶液显红色,证明某溶液中是否含有Fe3+,可以向溶液中加入硫氰化钾溶液,若溶液变成红色,证明溶液中含有铁离子,否则不含铁离子,
所以实验操作为:取样,加水溶解,往所得溶液中滴加硫氰化钾溶液,若溶液变红,则说明卤块中含铁离子,
故答案为:取样,加水溶解,往所得溶液中滴加硫氰化钾溶液,若溶液变红,则说明卤块中含铁离子;
(2)步骤②是为了将Fe2+氧化成Fe3+,并在控制合适的pH条件时生成Fe(OH)3沉淀而除之,虽然漂液和H2O2都可采用,但对比表2提供的原料价格可以看出,漂液比H2O2的价格低得多,所以选漂液最合理,故X为漂液;
故答案为:漂液(NaClO);
(3)加入Y的目的是调节pH,选用氢氧化钠,故Y为烧碱;加入的Z物质为纯碱,所以步骤④生成的沉淀物是MgCO3,所以步骤⑤中沉淀物MgCO3在煮沸的情况下发生水解,生成Mg(OH)2和CO2气体,反应的化学方程式为:MgCO3+H2O$\frac{\underline{\;煮沸\;}}{\;}$Mg(OH)2+CO2↑,
故答案为:烧碱(NaOH); MgCO3+H2O$\frac{\underline{\;煮沸\;}}{\;}$Mg(OH)2+CO2↑;
(4)步骤⑥由氢氧化镁灼烧制备氧化镁,应该在耐高温的坩埚中进行,
故答案为:坩埚;
(5)pH=4.0,c(H+)=0.0001mol/L,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$=10-10mol/L,25℃时,Fe(OH)3的溶度积常数Ksp=4.0×10-38,c(Fe3+)×c3(OH-)=4.0×10-38,c(Fe3+)=4×10-8mol/L,
故答案为:4×10-8mol/L.
点评 本题通过以卤块为原料制取轻质氧化镁的工艺流程,考查了物质制备实验方案的设计,题目难度中等,注意掌握化学基本实验操作方法,明确物质制备实验方案设计原则,本题中合理分析制取流程、得出氧化镁的制备原理为解题的关键,充分考查了学生的分析、理解能力及化学实验能力.

| A. | 8个中子的碳原子:12C | B. | HClO的结构式:H-Cl-O | ||
| C. | 镁离子的结构示意图: | D. | 15N的电子排布式:1s22s22p4 |
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)水钴矿进行预处理时加入Na2SO3的主要作用是将Fe3+、Co3+还原.
(2)写出NaClO3在浸出液中发生主要反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,a的取值范围是5.2≤a≤7.6;过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
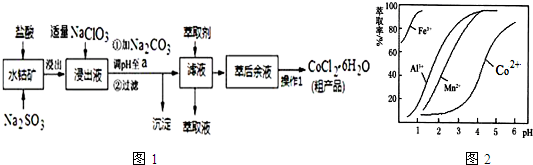
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O的含量,称取16.4g的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤、将沉淀烘干后称其质量为4.6g,则粗产品中CoCl2•6H2O的质量分数是93.0%.(结果保留小数点后一位数字)
| A. | 熔融状态下硫酸氢钾的电离方程式:KHSO4═K++HSO4- | |
| B. | NaHS水解:HS-+H2O═H3O++S2- | |
| C. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 碳酸电离:H2CO3═2H++CO32- |
 现有下列化学试剂:
现有下列化学试剂: