题目内容
【题目】下列叙述中正确的是( )
A.向NaHCO3溶液中滴加澄清石灰水,不会产生沉淀
B.等质量NaHCO3和Na2CO3分别与足量盐酸反应,生成的CO2在同温同压下体积相同
C.向Na2CO3溶液中缓慢通入等物质的量的HCl,生成的CO2与原Na2CO3的物质的量之比为1:2
D.向Na2CO3饱和溶液中通入CO2 , 有晶体析出
【答案】D
【解析】向NaHCO3溶液中滴加澄清石灰水,产生碳酸钙沉淀,故A错误;等质量NaHCO3和Na2CO3的物质的量比是 ![]() ,根据碳元素守恒,与足量盐酸反应生成同温同压下的二氧化碳的体积比是
,根据碳元素守恒,与足量盐酸反应生成同温同压下的二氧化碳的体积比是 ![]() ,故B错误;向Na2CO3溶液中缓慢通入等物质的量的HCl,只发生
,故B错误;向Na2CO3溶液中缓慢通入等物质的量的HCl,只发生 ![]() ,不生成CO2,故C错误;由于碳酸氢钠的溶解度小于碳酸钠,向Na2CO3饱和溶液中通入CO2,有碳酸氢钠晶体析出,故D正确。
,不生成CO2,故C错误;由于碳酸氢钠的溶解度小于碳酸钠,向Na2CO3饱和溶液中通入CO2,有碳酸氢钠晶体析出,故D正确。
故答案为:D
A.HCO3能和OH-反应转化成CO32-,所以向NaHCO3溶液中滴加澄清石灰水,产生碳酸钙沉淀,
B.等质量NaHCO3和Na2CO3的物质的量比是 1/ 84 : 1/ 106=106:84
C.Na2CO3溶液中缓慢通入等物质的量的HCl:Na2CO3+HCl=NaHCO3+NaCl
D.Na2CO3+H2O+CO2=2NaHCO3,106gNa2CO3会转化成168gNaHCO3,但是由于碳酸氢钠的溶解度小于碳酸钠,形成过饱和溶液而析出晶体

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案【题目】Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:
元素 | 相关信息 |
Q | Q的单质是实验室常用的惰性电极材料 |
R | R原子基态时2p原子轨道上有3个未成对电子 |
T | 负二价的元素T的氢化物在通常情况下是一种液体,且 T的质量分数为88.9% |
X | X是第三周期电负性最大的元素 |
Y | 元素Y位于周期表第10列 |
Z | Z存在质量数为65,中子数为36的核素 |
(1)Z元素的原子基态时的电子排布式是
(2)下列叙述正确的是 a.Q的最简单气态氢化物比R的气体氢化物稳定
b.Q的含氧酸一定比R的含氧酸酸性强
c.R的气态氢化物的熔点在同族元素形成的氢化物中最低
d.R的第一电离能、电负性都比Q大
(3)Q和T可形成两种常见化合物,分别表示为QT与QT2 . QT分子中σ键π键的个数比为;QT2分子中,Q原子采取杂化.
(4)笑气(R2T)是一种麻醉剂,有关理论认为R2T与QT2具有相似的结构.故的空间构型为 , 且为(填“极性”或“非极性”)分子.
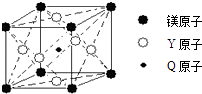
(5)现有Q、Y和镁三种元素的某种晶体具有超导性,其晶胞结构如图所示.该晶体的化学式为;晶体中每个镁原子周围距离相等且最近的Y原子有个.