题目内容
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B.水电离出的c(H+)=10-12 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
| C.c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl- |
| D.c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- |
C
解析

练习册系列答案
相关题目
实验室欲配制一种仅含有四种离子(不考虑来源水电离的离子)的溶液,且溶液中四种离子的浓度均相等,能达到此目的的是
| A.Na+、Mg2+、SO42—、Cl— | B.ClO—、I—、NH4+、Ba2+ |
| C.Na+、AlO2—、K+、HCO3— | D.Al3+、K+、SO42—、NO3— |
室温下,下列各组离子能大量共存的是
| A.稀硫酸中:K+、Mg2+、AlO2-、S2O32- |
| B.NaHS溶液中:SO42-、K+、Cl-、Cu2+ |
C.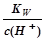 =10-13mol/L溶液中:Fe3+、NH4+、Mg2+、 SO42- =10-13mol/L溶液中:Fe3+、NH4+、Mg2+、 SO42- |
| D.通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
| A.向FeI2溶液中滴加少量氯水,反应的离子方程式为2Fe2++Cl2=3Fe3++2Cl- |
| B.向溴水中加入足量氯化亚铁溶液能使溴水变成无色 |
| C.向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O=2HClO+CO32- |
| D.能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存 |
含有下列各组离子的溶液中,通入(或加入)过量的某种物质后仍能大量共存的是( )
| A.H+、Ba2+、Fe3+、NO3—,通入SO2气体 |
| B.Ca2+、Cl-、K+、H+,通入CO2气体 |
| C.AlO2—、Na+、Br-、SO42—,通入CO2气体 |
| D.HCO3—、Na+、I-、HS-,加入AlCl3溶液 |
能正确表示下列反应的离子方程式是( )
A.过氧化钠固体与水反应:2O22—+2H2O 4OH-+O2↑ 4OH-+O2↑ |
B.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42—恰好沉淀完全:2Al3++3SO42—+3Ba2++6OH- 2Al(OH)3↓+3BaSO4↓ 2Al(OH)3↓+3BaSO4↓ |
C.向次氯酸钠溶液中通入少量SO2:ClO-+SO2+H2O Cl-+SO42—+2H+ Cl-+SO42—+2H+ |
D.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+ 4Fe3++2H2O 4Fe3++2H2O |
室温时,下列各组离子在指定溶液中可以大量共存的是( )
| A.由水电离出的c(H+)=10-12mol/L的溶液中:Na+、Ba2+、HCO3—、Cl- |
| B.无色透明溶液中:K+、Cu2+、SO42—、Na+ |
| C.含有大量AlO2—的溶液中:Na+、OH-、Cl-、CO32— |
| D.能使pH试纸显红色的溶液中:Na+、ClO-、Fe2+、SO42— |
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是 ( )。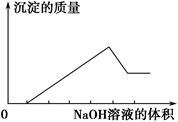
| A.①②⑤ | B.①③④ | C.②⑥⑦ | D.①②④⑥ |
向100 mL 0.1 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )
| A.a点时溶液中所含主要溶质为(NH4)2SO4 |
B.a→b段发生反应的离子方程式是:S +Ba2+ +Ba2+ BaSO4↓ BaSO4↓ |
| C.b点为最大沉淀量,对应的纵坐标值为0.02 |
| D.c点加入Ba(OH)2溶液的体积为200 Ml |