题目内容
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O;则该反应中还原产物是 ;若反应过程中转移了0.3mol电子,则氧化产物的质量是 g.
(2)将amolCl2 通入含bmolFeBr2的溶液中,当0<
≤
时,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,写出另2个可能发生的离子方程式.
①当
=1时 ;②当
≥
时 .
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O?Al(OH)4-+H+;②Cl2+2OH-=Cl-+ClO-+H2O
(Ⅰ)已知B (OH)3是一元弱酸,试写出其电离方程式: ;
(Ⅱ)单质氰(CN)2是类卤素,试写出其与氢氧化钠溶液反应的离子方程式 .
(2)将amolCl2 通入含bmolFeBr2的溶液中,当0<
| a |
| b |
| 1 |
| 2 |
①当
| a |
| b |
| a |
| b |
| 3 |
| 2 |
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O?Al(OH)4-+H+;②Cl2+2OH-=Cl-+ClO-+H2O
(Ⅰ)已知B (OH)3是一元弱酸,试写出其电离方程式:
(Ⅱ)单质氰(CN)2是类卤素,试写出其与氢氧化钠溶液反应的离子方程式
考点:氧化还原反应的电子转移数目计算,氧化还原反应的计算,氯气的化学性质,氯、溴、碘及其化合物的综合应用,镁、铝的重要化合物
专题:元素及其化合物
分析:(1)硝酸具有强氧化性,H2S具有较强还原性,二者反应氧化还原反应,故NO为还原产物、S为氧化产物,根据电子转移守恒计算S的物质的量,再根据m=nM计算S的质量;
(2)离子还原性Fe2+>Br-,首先发生:2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕再发生:2Br-+Cl2═Br2+2Cl-,根据比例关系确定参加反应各离子物质的量关系,进而书写总的离子方程式;
(3)(Ⅰ)B(OH)3是一元弱酸,类似Al(OH)3的电离,B(OH)3应是与水作用也生成生成酸根离子与氢离子;
(Ⅱ)单质氰(CN)2是类卤素,其性质与卤素单质相似,故与氢氧化钠溶液反应也生成两种盐,把CN看作1个卤原子,故生成盐离子为CN-、CNO-.
(2)离子还原性Fe2+>Br-,首先发生:2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕再发生:2Br-+Cl2═Br2+2Cl-,根据比例关系确定参加反应各离子物质的量关系,进而书写总的离子方程式;
(3)(Ⅰ)B(OH)3是一元弱酸,类似Al(OH)3的电离,B(OH)3应是与水作用也生成生成酸根离子与氢离子;
(Ⅱ)单质氰(CN)2是类卤素,其性质与卤素单质相似,故与氢氧化钠溶液反应也生成两种盐,把CN看作1个卤原子,故生成盐离子为CN-、CNO-.
解答:
解:(1)硝酸具有强氧化性,H2S具有较强还原性,二者反应氧化还原反应,故NO为还原产物、S为氧化产物,若反应过程中转移了0.3mol电子,由电子转移守恒,可知生成S的物质的量=
=0.15mol,故生成S的质量=0.15mol×32g/mol=4.8g,
故答案为:NO;4.8;
(2)离子还原性Fe2+>Br-,首先发生:2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕再发生:2Br-+Cl2═Br2+2Cl-,①当
=1时,Fe2+全部被氧化,Br-是Fe2+的2倍,只有一半的Br-被氧化性,反应离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-;
②当
≥
时,Fe2+、Br-全部被氧化,反应离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;
故答案为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-;2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;
(3)(Ⅰ)B(OH)3是一元弱酸,类似Al(OH)3的电离,B(OH)3应是与水作用也生成生成酸根离子,其电离方程式书为:B(OH)3+H2O?B(OH)4-+H+;
故答案为:B(OH)3+H2O?B(OH)4-+H+;
(Ⅱ)单质氰(CN)2是类卤素,其性质与卤素单质相似,故与氢氧化钠溶液反应也生成两种盐,把CN看作1个卤原子,故生成盐离子为CN-、CNO-,反应离子方程式为:(CN)2+2OH-=CN-+CNO-+H2O,
故答案为:(CN)2+2OH-=CN-+CNO-+H2O.
| 0.3mol |
| 2 |
故答案为:NO;4.8;
(2)离子还原性Fe2+>Br-,首先发生:2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕再发生:2Br-+Cl2═Br2+2Cl-,①当
| a |
| b |
②当
| a |
| b |
| 3 |
| 2 |
故答案为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-;2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;
(3)(Ⅰ)B(OH)3是一元弱酸,类似Al(OH)3的电离,B(OH)3应是与水作用也生成生成酸根离子,其电离方程式书为:B(OH)3+H2O?B(OH)4-+H+;
故答案为:B(OH)3+H2O?B(OH)4-+H+;
(Ⅱ)单质氰(CN)2是类卤素,其性质与卤素单质相似,故与氢氧化钠溶液反应也生成两种盐,把CN看作1个卤原子,故生成盐离子为CN-、CNO-,反应离子方程式为:(CN)2+2OH-=CN-+CNO-+H2O,
故答案为:(CN)2+2OH-=CN-+CNO-+H2O.
点评:本题考查的是氧化还原反应方程式配平与计算、弱电解质的电离等,难度中等,(2)中关键是根据离子还原性强弱顺序来分析解答.

练习册系列答案
相关题目
下列叙述中正确的是( )
| A、同系物不可能是同分异构体 |
| B、CH3Cl和CHCl3互为同系物 |
| C、同分异构体不能互称为同系物 |
| D、C4H10分子中四个碳原子在一条直线上 |
下列变化过程中,需要加入还原剂的是( )
| A、HCl→H2 |
| B、FeCl2→FeCl3 |
| C、Na2SO3→SO2 |
| D、Fe→Fe3O4 |
下列物质可以发生加成反应的是( )
| A、乙烷 | B、环丙烷 |
| C、乙烯 | D、聚乙烯 |
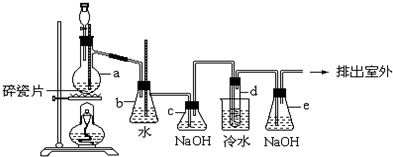
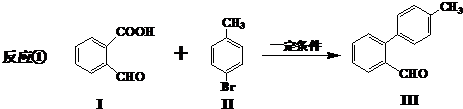
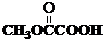 与
与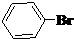 也可以发生类似反应①的反应,有机产物的结构简式为:
也可以发生类似反应①的反应,有机产物的结构简式为: