题目内容
如右图所示,组成一种原电池,试图答下问题(1)电解质溶液为稀H2SO4时,灯泡______(填亮或不亮),若灯泡亮,则Mg电极上反应式为______,Al电极上反应式为______;
(2)电解质溶液为NaOH(aq)时,灯泡______(填亮或不亮),若灯泡亮,Al电极上的反应式为______.
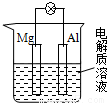
【答案】分析:原电池是把化学能转变为电能的装置,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应;原电池中有电流产生,如果能形成闭合回路,灯泡会亮;原电池中负极上失电子发生氧化反应,正极上得电子发生还原反应,据此分析.
解答:解:(1)镁、铝和稀硫酸能形成原电池,所以有电流产生,因为形成了闭合回路,所以灯泡会亮;金属活泼性较强的镁作负极,负极上镁失电子发生氧化反应,即Mg-2e-═Mg2+;铝作正极,正极上氢离子得电子反应还原反应生成氢气,即2H++2e-═H2↑,
故答案为:亮;Mg-2e-═Mg2+;2H++2e-═H2↑;
(2)镁、铝和NaOH(aq)构成原电池,所以有电流产生,因为形成了闭合回路,所以灯泡会亮;铝和氢氧化钠溶液能自发的发生氧化还原反应,所以铝作负极,镁作正极,负极上铝失电子发生氧化反应和氢氧根离子生成偏铝酸根离子和水,即Al+4OH--3e-═AlO2-+2H2O,
故答案为:亮;Al+4OH--3e-═AlO2-+2H2O.
点评:本题考查了原电池的构成条件,难度不大,注意原电池正负极的确定不能单纯根据金属的活泼性判断,要根据发生反应的反应类型确定.
解答:解:(1)镁、铝和稀硫酸能形成原电池,所以有电流产生,因为形成了闭合回路,所以灯泡会亮;金属活泼性较强的镁作负极,负极上镁失电子发生氧化反应,即Mg-2e-═Mg2+;铝作正极,正极上氢离子得电子反应还原反应生成氢气,即2H++2e-═H2↑,
故答案为:亮;Mg-2e-═Mg2+;2H++2e-═H2↑;
(2)镁、铝和NaOH(aq)构成原电池,所以有电流产生,因为形成了闭合回路,所以灯泡会亮;铝和氢氧化钠溶液能自发的发生氧化还原反应,所以铝作负极,镁作正极,负极上铝失电子发生氧化反应和氢氧根离子生成偏铝酸根离子和水,即Al+4OH--3e-═AlO2-+2H2O,
故答案为:亮;Al+4OH--3e-═AlO2-+2H2O.
点评:本题考查了原电池的构成条件,难度不大,注意原电池正负极的确定不能单纯根据金属的活泼性判断,要根据发生反应的反应类型确定.

练习册系列答案
相关题目
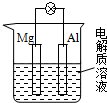 如右图所示,组成一种原电池,试图答下问题
如右图所示,组成一种原电池,试图答下问题 已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素.其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍.D、E为同主族元素,且E的原子序数为D的2倍.F元素在地壳中含量位于金属元素的第二位.试回答下列问题:
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素.其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍.D、E为同主族元素,且E的原子序数为D的2倍.F元素在地壳中含量位于金属元素的第二位.试回答下列问题:


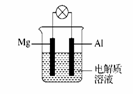 (1)电解质溶液为稀H2SO4时,灯泡 (填“亮”或“不亮”)。若灯泡亮,则Mg为原电池的 极;
(1)电解质溶液为稀H2SO4时,灯泡 (填“亮”或“不亮”)。若灯泡亮,则Mg为原电池的 极;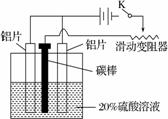 (2)电解质溶液为NaOH溶液时,灯泡 (填“亮”或“不亮”)。若灯泡亮,则Al做原电池的 极。若灯泡不亮,其理由为 。
(2)电解质溶液为NaOH溶液时,灯泡 (填“亮”或“不亮”)。若灯泡亮,则Al做原电池的 极。若灯泡不亮,其理由为 。