题目内容
根据以下叙述,回答1至3题。工业上制氯化铜时,是将浓盐酸用蒸气加热至![]() CuCl2+H2O,FeO+2HCl
CuCl2+H2O,FeO+2HCl![]() FeCl2+H2O。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3—4时,Fe3+以Fe(OH)3的形式完全沉淀。
FeCl2+H2O。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3—4时,Fe3+以Fe(OH)3的形式完全沉淀。
1.为除去溶液中的Fe2+,可以采用的方法是( )
A.直接加碱,调整溶液pH≥9.6 B.加纯铜粉,将Fe2+还原出来
C.先将Fe2+氧化成Fe3+,再调整pH在3—4 D.通入硫化氢,使Fe2+直接沉淀
2.根据信息,工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,溶液pH变化情况是( )
A.肯定减小 B.肯定增大 C.可能减小 D.可能增大
3.根据信息,若此溶液中只含有Fe3+时,要调整pH在3—4之间,此时最好向溶液中加入( )
A.NaOH溶液 B.氨水 C.CuCl2溶液 D.CuO固体
1.C 解析:A选项中,pH≥9.6时,Cu2+已被沉淀完全。D选项中,H2S和Fe2+不反应。
2.B 解析:发生反应的离子方程式:2Fe2++ClO-+H2O![]() 2Fe3++Cl-+2OH-。
2Fe3++Cl-+2OH-。
3.D 解析:除杂的基本原则是不能引入新的杂质,故A、B排除。C中CuCl2不与H+发生反应,所以不能调节溶液的pH。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案根据以下叙述,回答1-3小题:下图是4个碳原子相互结合的8种有机物(氢原子没有画出)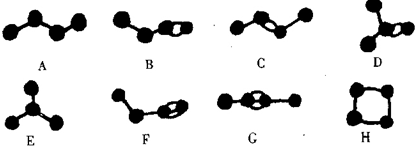
【小题1】有机物E的名称是( )
| A.丁烷 | B.2-甲基丙烷 | C.1-甲基丙烷 | D.甲烷 |
| A.B | B.F | C.G | D.H |
A.同位素 B.同系物 C.同分异构体 D.同素异形体
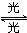 O2+O Cl+O3→ClO+O2 ClO+O→O2 总反应 2O3→3O2在上述臭氧变成氧气的反应过程中,Cl是( )
O2+O Cl+O3→ClO+O2 ClO+O→O2 总反应 2O3→3O2在上述臭氧变成氧气的反应过程中,Cl是( )