题目内容
17.下列物质的化学名称、化学式和俗名一致的是( )| A. | 碳酸钙CaCO3熟石灰 | B. | 氢氧化钠NaOH纯碱 | ||
| C. | 碳酸钠Na2CO3苏打 | D. | 碳酸氢钠NaHCO3苏打 |
分析 A、熟石灰的化学式为Ca(OH)2;
B、氢氧化钠俗称烧碱;
C、碳酸钠俗称苏打;
D、碳酸氢钠俗称小苏打.
解答 解:A、熟石灰的化学式为Ca(OH)2,不是CaCO3,碳酸钙俗称石灰石,故A错误;
B、氢氧化钠俗称烧碱,纯碱是碳酸钠,故B错误;
C、碳酸钠俗称苏打,化学式为Na2CO3,故C正确;
D、碳酸氢钠俗称小苏打,化学式为NaHCO3,苏打是碳酸钠,故D错误.
故选C.
点评 本题考查了常见物质的化学式的书写和俗称,掌握基础是关键,难度不大.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
8.某饱和一元醇与浓硫酸共热得到一种无同分异构体的烯烃,该醇分子中的碳原子数一定为( )
| A. | 1 | B. | 4 | C. | 3 | D. | 6 |
12.在入住新装修的新房之前,下列做法错误的是( )
| A. | 紧闭门窗,防止装修面干裂或变质 | |
| B. | 适度开窗通风,充分进行室内外空气对流 | |
| C. | 请专业环境监测人员进行检测 | |
| D. | 在各个房间均匀地适量放置吊兰、芦荟等 |
2.下列所描述的变化不属于化学变化的是( )
| A. | 用一种原子制造出另一种或几种原子 | |
| B. | 碳酸氢铵受热分解 | |
| C. | 蓝矾加热后变为白色固体 | |
| D. | 电解水生成氢气和氧气 |
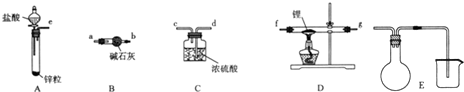
7.用如图装置不能达到有关实验目的是( ) 

| A. | 用甲图装置电解精炼铝 | |
| B. | 用乙图装置制备 Fe(OH)2 | |
| C. | 用丙图装置可制得金属锰 | |
| D. | 用丁图装置验证 NaHCO3 和 Na2CO3的热稳定性 |
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
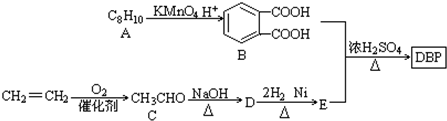
 $\stackrel{KMnO_{2}H+}{→}$
$\stackrel{KMnO_{2}H+}{→}$
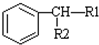
 (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)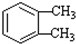 ,D→E的反应类型加成(或还原)反应.
,D→E的反应类型加成(或还原)反应.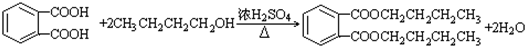 .
.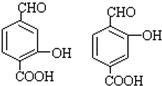 .
.