题目内容
某温度下,CO2饱和溶液的浓度是0.03mol?L-1,其中1/3的CO2转变为H2CO3,而H2CO3仅有0.1%发生如下电离:H2CO3 H++HCO3-,则溶液的pH约为( )
H++HCO3-,则溶液的pH约为( )
 H++HCO3-,则溶液的pH约为( )
H++HCO3-,则溶液的pH约为( )分析:根据二氧化碳饱和溶液中二氧化碳的浓度计算生成的碳酸的浓度,根据碳酸的浓度和电离度计算氢离子浓度,pH=-lg[C(H+)].
解答:解:CO2饱和溶液的浓度是0.03mol?L-1,其中1/3的CO2转变为H2CO3,而H2CO3仅有0.1%发生如下电离,所以氢离子的浓度为0.03mol/L×
×0.1%=10-5 mol/L,所以pH=5,
故选C.
| 1 |
| 3 |
故选C.
点评:本题考查了溶液pH值的计算,难度不大,明确溶液pH值的计算方法是解本题的关键.

练习册系列答案
相关题目
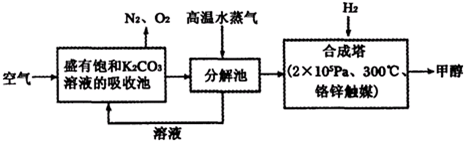
 2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议.而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
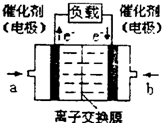
2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议.而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.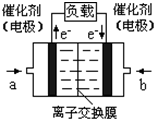 意图,则a处通入的是
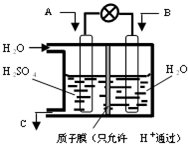
意图,则a处通入的是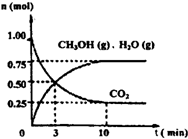 (2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.