��Ŀ����
����Ŀ���Ը�����[��Ҫ�ɷ�Ϊ![]() ��������
��������![]() ������]Ϊԭ������
������]Ϊԭ������![]() ��һ�ֹ����������£�
��һ�ֹ����������£�
�ش��������⣺
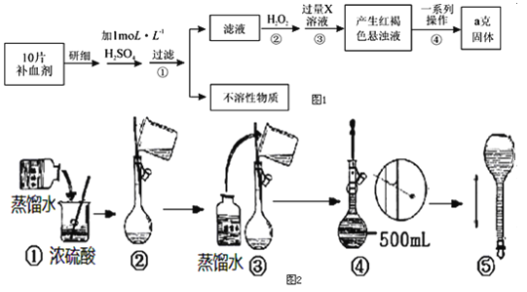
��1��![]() �������������ʽ��ʾΪ___________��
�������������ʽ��ʾΪ___________��
��2����������ʱ![]() �ֱ��봿�Ӧ���������ֱ�Ϊ
�ֱ��봿�Ӧ���������ֱ�Ϊ![]() ��___________��
��___________��![]() ������Ӧ�Ĺ��������Ϊ
������Ӧ�Ĺ��������Ϊ![]() ��һ�ֺ���ɫ���壬�÷�Ӧ�Ļ�ѧ����ʽΪ______________________�����������У�������������ʵ�����н��У�����ѡ�õ�����Ϊ___________�����ţ���
��һ�ֺ���ɫ���壬�÷�Ӧ�Ļ�ѧ����ʽΪ______________________�����������У�������������ʵ�����н��У�����ѡ�õ�����Ϊ___________�����ţ���
a.�ձ� b.������ c.������ d.������
��3������I����Ҫ�ɷ���___________������pH=7��Ŀ����___________��
��4���ٴε���pH������Һ���м���![]() ʹpH��С����Һ�ɻ�ɫ��Ϊ��ɫ��������Ӧ�����ӷ���ʽΪ______________________���ܷ����������
ʹpH��С����Һ�ɻ�ɫ��Ϊ��ɫ��������Ӧ�����ӷ���ʽΪ______________________���ܷ����������![]() ����pH___________����ܡ�����
����pH___________����ܡ�����
��5�����ɫ��Һ�м���![]() ���壬���
���壬���![]() ����IJ��������Ǽ���Ũ����___________�����ˡ�ϴ�ӡ����
����IJ��������Ǽ���Ũ����___________�����ˡ�ϴ�ӡ����
���𰸡�FeO��Cr2O3 Na2SiO3 4Fe(CrO2)2+7O2+8Na2CO3 ![]() 2Fe2O3 +8Na2CrO4+8CO2 d Fe2O3 ʹAlO2-��SiO32-�γ�Al(OH)3��H2SiO3������ȥ 2CrO42- +2H+
2Fe2O3 +8Na2CrO4+8CO2 d Fe2O3 ʹAlO2-��SiO32-�γ�Al(OH)3��H2SiO3������ȥ 2CrO42- +2H+![]() Cr2O72-+H2O �� ��ȴ�ᾧ
Cr2O72-+H2O �� ��ȴ�ᾧ
��������
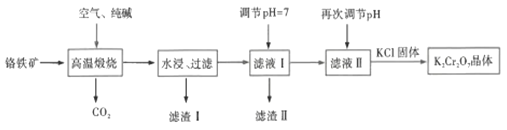
��1��![]() ��FeΪ+2�ۡ�CrΪ+3�ۣ�
��FeΪ+2�ۡ�CrΪ+3�ۣ�
��2����������ʱ SiO2�봿�Ӧ���ɹ����ƺͶ�����̼��![]() �봿�Ӧ�Ĺ��������Ϊ
�봿�Ӧ�Ĺ��������Ϊ![]() ��һ�ֺ���ɫ���壬����Ԫ���غ㣬����ɫ����������������������Ӧ���������н��У����������ڹ����Σ������������봿�Ӧ��
��һ�ֺ���ɫ���壬����Ԫ���غ㣬����ɫ����������������������Ӧ���������н��У����������ڹ����Σ������������봿�Ӧ��
��3���������յIJ�����![]() ��Na2SiO3��
��Na2SiO3��![]() ��Fe2O3�� pH=7ʱ��AlO2-��SiO32-�γ�Al(OH)3��H2SiO3������
��Fe2O3�� pH=7ʱ��AlO2-��SiO32-�γ�Al(OH)3��H2SiO3������
��4������������CrO42-ת��ΪCr2O72-��Cr2O72-�����������ӣ�
��5��������K2Cr2O7������ܽ��С��Na2Cr2O7��
��1��![]() ��FeΪ+2�ۡ�CrΪ+3�ۣ������������ʽ��ʾΪFeO��Cr2O3��
��FeΪ+2�ۡ�CrΪ+3�ۣ������������ʽ��ʾΪFeO��Cr2O3��
��2����������ʱ SiO2�봿�Ӧ���ɹ����ƺͶ�����̼�����������Na2SiO3��![]() �봿�Ӧ�Ĺ��������Ϊ
�봿�Ӧ�Ĺ��������Ϊ![]() ��һ�ֺ���ɫ���壬����Ԫ���غ㣬����ɫ����������������Ӧ����ʽ��4Fe(CrO2)2+7O2+8Na2CO3
��һ�ֺ���ɫ���壬����Ԫ���غ㣬����ɫ����������������Ӧ����ʽ��4Fe(CrO2)2+7O2+8Na2CO3 ![]() 2Fe2O3 +8Na2CrO4+8CO2����������Ӧ���������н��У����������ڹ����Σ������������봿�Ӧ����ѡd��
2Fe2O3 +8Na2CrO4+8CO2����������Ӧ���������н��У����������ڹ����Σ������������봿�Ӧ����ѡd��
��3���������յIJ�����![]() ��Na2SiO3��
��Na2SiO3��![]() ��Fe2O3��ֻ��Fe2O3������ˮ����������1�ijɷ���Fe2O3������pH=7��Ŀ����ʹAlO2-��SiO32-�γ�Al(OH)3��H2SiO3������ȥ��
��Fe2O3��ֻ��Fe2O3������ˮ����������1�ijɷ���Fe2O3������pH=7��Ŀ����ʹAlO2-��SiO32-�γ�Al(OH)3��H2SiO3������ȥ��
��4������������CrO42-ת��ΪCr2O72-���ٴε���pH������Һ���м���![]() ʹpH��С����Һ�ɻ�ɫ��Ϊ��ɫ��������Ӧ�����ӷ���ʽΪ2CrO42- +2H+
ʹpH��С����Һ�ɻ�ɫ��Ϊ��ɫ��������Ӧ�����ӷ���ʽΪ2CrO42- +2H+![]() Cr2O72-+H2O��Cr2O72-�����������ӣ�����������������
Cr2O72-+H2O��Cr2O72-�����������ӣ�����������������
��5��������K2Cr2O7������ܽ��С��Na2Cr2O7�����ɫ��Һ�м���![]() ���壬���
���壬���![]() ����IJ��������Ǽ���Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����
����IJ��������Ǽ���Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����