题目内容
在标准状况下,10L有H2、CO2、CO、N2组成的混合气体中,再通入6.0LO2,使之燃烧后,测得同温同压下气体体积为7.5L,将这些气体通过盛有NaOH的洗气瓶,其体积变为2.0L,该2.0L气体在标准状况下是氢气密度的15.5倍,计算原混合气体中各种体积的体积及CO的质量.
答案:
解析:
解析:
|
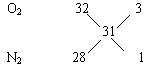
解析:通入O2后,发生反应方程式为:2H2+O2 V(CO)+V(CO2)=7.5L-2L=5.5L ① 剩下的2L气体的平均摩尔质量:15.5×2=31g/mol,应为氮气和氧气的混合气体.利用十字交叉法:
所以V(N2)= 又因:V(H2)+V(CO)+V(CO2)=10L-0.50L=9.5L ③ 联解①②③方程组可解得:V(H2)=4.0L;V(CO)=5.0L;V(CO2)=0.50L. 所以,m(CO)=n·M= |

练习册系列答案
相关题目
 O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g); CH3OH(g);△H=-Q kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
CH3OH(g);△H=-Q kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。

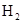 、
、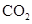 、
、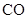 、
、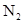 组成的混合气体中通入
组成的混合气体中通入 ,用电火花引燃,使之充分反应后,测得气体体积为7.5L,将这些气体通入盛有过量
,用电火花引燃,使之充分反应后,测得气体体积为7.5L,将这些气体通入盛有过量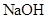 溶液的洗气瓶气体的体积变为2L,这2L气体的密度是相同状况下
溶液的洗气瓶气体的体积变为2L,这2L气体的密度是相同状况下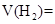 _______________;
_______________;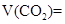 _________________;
_________________;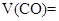 _______________;
_______________;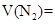 _________________。
_________________。