题目内容
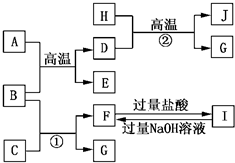
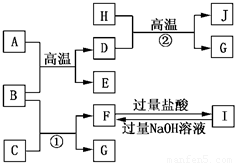
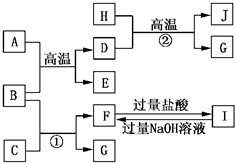 如图A~J均代表不同物质或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体.
如图A~J均代表不同物质或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体.根据图示回答问题:
(1)写出下列物质的化学式:B
Al
Al
,EAl2O3
Al2O3
,IAlCl3
AlCl3
,JFe3O4
Fe3O4
;(2)反应①的离子方程式是
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
;E→F的化学方程式是
Al2O3+2NaOH═2NaAlO2+H2O
Al2O3+2NaOH═2NaAlO2+H2O
;(3)F与过量盐酸反应的离子方程式是
AlO2-+4H+═Al3++2H2O
AlO2-+4H+═Al3++2H2O
.分析:B是地壳中含量最高的金属元素,B为Al,由H+D
G+J,G是气体,J是磁性材料,常温下H为无色液体,该转化为Fe+H2O
Fe3O4+H2,故D为Fe,H为H2O,J为Fe3O4,G为H2,故A+B
D+E为铝热反应,A为Fe2O3,E为Al2O3;
由反应①Al+C→F+H2,C为酸或碱,F为铝盐后偏铝酸盐,由转化关系F
I可知,F为NaAlO2,I为AlCl3,故C为NaOH.
| 高温 |
| 高温 |
| 高温 |
由反应①Al+C→F+H2,C为酸或碱,F为铝盐后偏铝酸盐,由转化关系F
| 过量盐酸 |
| 过量氢氧化钠 |
解答:解:B是地壳中含量最高的金属元素,B为Al,由H+D
G+J,G是气体,J是磁性材料,常温下H为无色液体,该转化为Fe+H2O
Fe3O4+H2,故D为Fe,H为H2O,J为Fe3O4,G为H2,故A+B
D+E为铝热反应,A为Fe2O3,E为Al2O3;
由反应①Al+C→F+H2,C为酸或碱,F为铝盐后偏铝酸盐,由转化关系F
I可知,F为NaAlO2,I为AlCl3,故C为NaOH,
(1)由上述分析可知,B为Al,E为Al2O3,I为AlCl3,J为Fe3O4,故答案为:Al;Al2O3;AlCl3;Fe3O4;
(2)反应①是铝与氢氧化钠反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
E→F的转化是氧化铝转化为偏铝酸钠,故应为氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:Al2O3+2NaOH═2NaAlO2+H2O,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;Al2O3+2NaOH═2NaAlO2+H2O;
(3)NaAlO2与过量盐酸反应生成氯化铝与水,反应离子方程式为:AlO2-+4H+═Al3++2H2O,故答案为:AlO2-+4H+═Al3++2H2O.
| 高温 |
| 高温 |
| 高温 |
由反应①Al+C→F+H2,C为酸或碱,F为铝盐后偏铝酸盐,由转化关系F
| 过量盐酸 |
| 过量氢氧化钠 |
(1)由上述分析可知,B为Al,E为Al2O3,I为AlCl3,J为Fe3O4,故答案为:Al;Al2O3;AlCl3;Fe3O4;
(2)反应①是铝与氢氧化钠反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
E→F的转化是氧化铝转化为偏铝酸钠,故应为氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:Al2O3+2NaOH═2NaAlO2+H2O,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;Al2O3+2NaOH═2NaAlO2+H2O;
(3)NaAlO2与过量盐酸反应生成氯化铝与水,反应离子方程式为:AlO2-+4H+═Al3++2H2O,故答案为:AlO2-+4H+═Al3++2H2O.
点评:本题以无机框图题的形式考查Al、Fe等元素单质及其化合物之间的相互转化关系和逻辑推理能力、化学用语的书写能力,本题中B的含量,G是气体,J是磁性材料,常温下H为无色液体结合H+D
G+J转化等均为解题突破口,难度中等,再结合转化关系进行推理判断.
| 高温 |

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目

 +(2n-1)H2O
+(2n-1)H2O