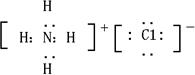题目内容
(2008?开封一模)t℃时,将2mol N2和1mol H2通入体积为2L的恒温容密闭容器中,发生如下反应:N2(g)+3H2(g)?2NH3(g);△H<0.2min后反应达到平衡,此时测得NH3的物质的量为0.2mol.请填写下列空白:
(1)从反应开始至达到化学平衡,生成NH3的平均反应速率为
(2)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
A.容器内压强不再发生变化
B.H2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗n mol N2的同时消耗3n mol H2
E.相同时间内消耗n mol N2的同时消耗2n mol NH3
F.容器内气体的密度不再发生变化
(3)反应达平衡后,以下操作将引起平衡向正反应方向移动,并能提高N2转化率的是:
A.向容器中通入少量N2
B.向容器中通入少量H2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气(已知氦气和N2、H2、NH3都不发生反应)
(4)维持上述恒温恒容条件步变,若起始加入a mol N2、b mol H2、c mol NH3,反应向逆方向进行,平衡时NH3的物质的量仍然为0.2mol,则c的取值范围是
(5)保持温度不变,使体积缩小为原来的一半,则N2的体积分数
(1)从反应开始至达到化学平衡,生成NH3的平均反应速率为
0.05mol/(L?min)
0.05mol/(L?min)
;平衡时N2转化率为5%
5%
.(2)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
ABE
ABE
.A.容器内压强不再发生变化
B.H2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗n mol N2的同时消耗3n mol H2
E.相同时间内消耗n mol N2的同时消耗2n mol NH3
F.容器内气体的密度不再发生变化
(3)反应达平衡后,以下操作将引起平衡向正反应方向移动,并能提高N2转化率的是:
BD
BD
A.向容器中通入少量N2
B.向容器中通入少量H2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气(已知氦气和N2、H2、NH3都不发生反应)
(4)维持上述恒温恒容条件步变,若起始加入a mol N2、b mol H2、c mol NH3,反应向逆方向进行,平衡时NH3的物质的量仍然为0.2mol,则c的取值范围是
0.2<C≤
| 2 |
| 3 |
0.2<C≤
.| 2 |
| 3 |
(5)保持温度不变,使体积缩小为原来的一半,则N2的体积分数
增大
增大
(填“增大”“减小”或“不变”).请通过计算证明你的结论.N2(g)+3H2(g)?2NH3(g)
原平衡 1.9 0.7 0.2
转化x3x2x
新平衡 1.9-x 0.7-3x 0.2+2x
W(N2后)-W(N2前)=
-
=
,因x≤0.35,所以
>O
原平衡 1.9 0.7 0.2
转化x3x2x
新平衡 1.9-x 0.7-3x 0.2+2x
W(N2后)-W(N2前)=
| 1.9-x |
| 2.8-2x |
| 1.9 |
| 2.8 |
| x |
| 28(2.8-2x) |
| x |
| 28(2.8-2x) |
N2(g)+3H2(g)?2NH3(g)
原平衡 1.9 0.7 0.2
转化x3x2x
新平衡 1.9-x 0.7-3x 0.2+2x
W(N2后)-W(N2前)=
-
=
,因x≤0.35,所以
>O
.原平衡 1.9 0.7 0.2
转化x3x2x
新平衡 1.9-x 0.7-3x 0.2+2x
W(N2后)-W(N2前)=
| 1.9-x |
| 2.8-2x |
| 1.9 |
| 2.8 |
| x |
| 28(2.8-2x) |
| x |
| 28(2.8-2x) |
分析:(1)根据反应速率公式计算;由N2(g)+3H2(g)?2NH3(g)可知,生成氨气0.2mol时参加反应的氮气为0.1mol,以此计算转化率;
(2)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,据此判断,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)根据化学平衡的影响因素来回答;
(4)根据题意及平衡逆向移动来考虑;
(5)根据平衡三部曲计算出各物质的物质的量,然后求出体积改变前后N2的体积分数来比较大小.
(2)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,据此判断,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)根据化学平衡的影响因素来回答;
(4)根据题意及平衡逆向移动来考虑;
(5)根据平衡三部曲计算出各物质的物质的量,然后求出体积改变前后N2的体积分数来比较大小.
解答:解:(1)达到平衡时氨气增加0.10mol/L,其反应速率v=为
=0.5mol/(L.min);
由N2(g)+3H2(g)?2NH3(g)可知,生成氨气0.2mol时参加反应的氮气为0.1mol,所以氮气的转化率为=
×100%=5%,
故答案为:0.5mol/(L.min);5%;
(2)A.随反应进行气体的物质的量减少,压强降低,容器内压强不再发生变化,说明到达平衡,故A正确;
B.达到平衡状态时,各物质的百分含量不变,H2的体积分数不再发生变化,说明到达平衡,故B正确;
C.在任何时候,由质量守恒可知,容器内气体原子总数不再发生变化,所以容器内气体原子总数不再发生变化不能说明到达平衡,故C错误;
D.在任何时候,相同时间内消耗n mol N2的同时消耗3n mol H2,无法到达平衡,故D错误;
E.相同时间内消耗n mol N2的同时消耗2n mol NH3,则V正=V逆,说明反应到达平衡,故E正确;
故选:ABE;
(3)A.向容器中通入少量N2,即增大N2的浓度,能使平衡正向移动并能提高H2转化率,本身的转化率降低,故A错误;
B.向容器中通入少量H2,即增大H2的浓度,能使平衡正向移动并能提高N2转化率,本身的转化率降低,故B正确;
C.使用催化剂,不会影响化学平衡的移动,也不会改变N2转化率,故C错误;
D.降低温度,化学平衡正向移动,并能提高N2转化率,故D正确;
E.向容器中通入少量氦气,当恒容时,各组分的浓度不变,则平衡不移动,故E错误.
故选:BD;
(4)将2mol N2和1mol H2通入体积为2L的恒温容密闭容器中,发生如下反应:N2(g)+3H2(g)?2NH3(g),平衡时NH3的物质的量等于0.2mol,若反应完全进行,NH3的物质的量等于
mol,所以要满足平衡逆向移动,则NH3的物质的量应为:0.2<C≤
,故答案为:0.2<C≤
;
(5)设压强增大后,又消耗的氮气为x mol
N2(g)+3H2(g)?2NH3(g)
原平衡 1.9 0.7 0.2
转化x 3x 2x
新平衡 1.9-x 0.7-3x 0.2+2x
W(N2后)-W(N2前)=
-
=
,因x≤0.35,所以
>O;
故答案为:增大;
N2(g)+3H2(g)?2NH3(g)
原平衡 1.9 0.7 0.2
转化x 3x 2x
新平衡 1.9-x 0.7-3x 0.2+2x
W(N2后)-W(N2前)=
-
=
,因x≤0.35,所以
>O.
| 0.10mol/L |
| 0.2min |
由N2(g)+3H2(g)?2NH3(g)可知,生成氨气0.2mol时参加反应的氮气为0.1mol,所以氮气的转化率为=
| 0.1mol |
| 2mol |
故答案为:0.5mol/(L.min);5%;
(2)A.随反应进行气体的物质的量减少,压强降低,容器内压强不再发生变化,说明到达平衡,故A正确;
B.达到平衡状态时,各物质的百分含量不变,H2的体积分数不再发生变化,说明到达平衡,故B正确;
C.在任何时候,由质量守恒可知,容器内气体原子总数不再发生变化,所以容器内气体原子总数不再发生变化不能说明到达平衡,故C错误;
D.在任何时候,相同时间内消耗n mol N2的同时消耗3n mol H2,无法到达平衡,故D错误;
E.相同时间内消耗n mol N2的同时消耗2n mol NH3,则V正=V逆,说明反应到达平衡,故E正确;
故选:ABE;
(3)A.向容器中通入少量N2,即增大N2的浓度,能使平衡正向移动并能提高H2转化率,本身的转化率降低,故A错误;
B.向容器中通入少量H2,即增大H2的浓度,能使平衡正向移动并能提高N2转化率,本身的转化率降低,故B正确;
C.使用催化剂,不会影响化学平衡的移动,也不会改变N2转化率,故C错误;
D.降低温度,化学平衡正向移动,并能提高N2转化率,故D正确;
E.向容器中通入少量氦气,当恒容时,各组分的浓度不变,则平衡不移动,故E错误.
故选:BD;
(4)将2mol N2和1mol H2通入体积为2L的恒温容密闭容器中,发生如下反应:N2(g)+3H2(g)?2NH3(g),平衡时NH3的物质的量等于0.2mol,若反应完全进行,NH3的物质的量等于
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
(5)设压强增大后,又消耗的氮气为x mol
N2(g)+3H2(g)?2NH3(g)
原平衡 1.9 0.7 0.2
转化x 3x 2x
新平衡 1.9-x 0.7-3x 0.2+2x
W(N2后)-W(N2前)=
| 1.9-x |
| 2.8-2x |
| 1.9 |
| 2.8 |
| x |
| 28(2.8-2x) |
| x |
| 28(2.8-2x) |
故答案为:增大;
N2(g)+3H2(g)?2NH3(g)
原平衡 1.9 0.7 0.2
转化x 3x 2x
新平衡 1.9-x 0.7-3x 0.2+2x
W(N2后)-W(N2前)=
| 1.9-x |
| 2.8-2x |
| 1.9 |
| 2.8 |
| x |
| 28(2.8-2x) |
| x |
| 28(2.8-2x) |
点评:本题主要考查了化学反应速率,转化率,平衡状态的判断以及化学平衡移动,难度中等,注意平衡三部曲的运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2008?开封一模)短周期元素的常见单质A、B、C、D在通常状况下均为气态,其中B分子中共价键最多,单质A分别与B、C、D在一定条件下发生反应,得到相应的共价化合物E、F、G,通常状况下F为液体,E、G为气体,且E与G可反应得到离子化合物H,H中的阳离子含有10个电子,阴离子含有18个电子.
(2008?开封一模)短周期元素的常见单质A、B、C、D在通常状况下均为气态,其中B分子中共价键最多,单质A分别与B、C、D在一定条件下发生反应,得到相应的共价化合物E、F、G,通常状况下F为液体,E、G为气体,且E与G可反应得到离子化合物H,H中的阳离子含有10个电子,阴离子含有18个电子.