题目内容
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g) Mx(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法正确的是 ( )
Mx(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法正确的是 ( )
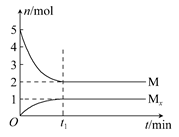
 Mx(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法正确的是 ( )
Mx(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法正确的是 ( )
A.该反应的化学方程式是2HF (HF)2 (HF)2 |
| B.平衡时混合气体的平均摩尔质量是33.3 |
C.t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时,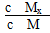 将增大 将增大 |
| D.M的沸点比同主族下一周期元素的气态氢化物沸点低 |
C
由图像知反应物和生成物的化学计量数之比为3:1,故其化学方程式为3HF (HF)3,A错。平衡混合气体中含2 mol HF、1 mol (HF)3,
(HF)3,A错。平衡混合气体中含2 mol HF、1 mol (HF)3,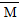 =(2 mol×20 g·mol-1+1 mol×60g·mol-1)÷3 mol=33.3 g·mol-1,选项B中漏写单位而错。选项C相当于对体系实施加压,增大压强有利于反应正向进行,故比值增大,C正确。由于HF分子间存在氢键易形成缔合分子,故其沸点比HCl高,D错。
=(2 mol×20 g·mol-1+1 mol×60g·mol-1)÷3 mol=33.3 g·mol-1,选项B中漏写单位而错。选项C相当于对体系实施加压,增大压强有利于反应正向进行,故比值增大,C正确。由于HF分子间存在氢键易形成缔合分子,故其沸点比HCl高,D错。
 (HF)3,A错。平衡混合气体中含2 mol HF、1 mol (HF)3,
(HF)3,A错。平衡混合气体中含2 mol HF、1 mol (HF)3,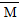 =(2 mol×20 g·mol-1+1 mol×60g·mol-1)÷3 mol=33.3 g·mol-1,选项B中漏写单位而错。选项C相当于对体系实施加压,增大压强有利于反应正向进行,故比值增大,C正确。由于HF分子间存在氢键易形成缔合分子,故其沸点比HCl高,D错。
=(2 mol×20 g·mol-1+1 mol×60g·mol-1)÷3 mol=33.3 g·mol-1,选项B中漏写单位而错。选项C相当于对体系实施加压,增大压强有利于反应正向进行,故比值增大,C正确。由于HF分子间存在氢键易形成缔合分子,故其沸点比HCl高,D错。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 C(g)+D(g),5 min后达平衡,已知各物质的平衡浓度的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下,将容器的体积扩大为原来的10倍,A的转化率没有发生变化,则B的转化率为( )
C(g)+D(g),5 min后达平衡,已知各物质的平衡浓度的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下,将容器的体积扩大为原来的10倍,A的转化率没有发生变化,则B的转化率为( ) bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度变为原来的50%,则
bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度变为原来的50%,则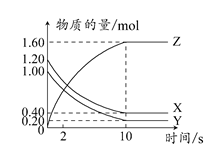
 2Z(g),平衡常数K=40
2Z(g),平衡常数K=40 2HI(g) ΔH<0,当达到平衡后,t1时刻改变反应的某一条件(混合气体总物质的量不变),造成容器内压强增大,则下列说法中正确的是 ( )
2HI(g) ΔH<0,当达到平衡后,t1时刻改变反应的某一条件(混合气体总物质的量不变),造成容器内压强增大,则下列说法中正确的是 ( )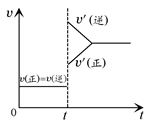
 2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是( )
2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是( )

 2A2B(g)。反应达到平衡时A2B为0.3 mol。若此时移走0.5 mol A2和0.5 mol B2,则重新达到平衡后,A2B的物质的量( )
2A2B(g)。反应达到平衡时A2B为0.3 mol。若此时移走0.5 mol A2和0.5 mol B2,则重新达到平衡后,A2B的物质的量( ) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在I中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在I中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )