题目内容
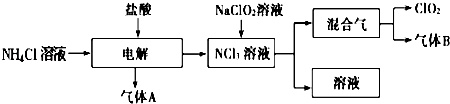
【题目】实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO47H2O),其过程如图1所示:
(1)画出铁的原子结构示意图 ,
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为 .
(3)过程③中,需要加入的物质名称是 . 过程④的实验操作 .
(4)过程⑥中,将溶液Z加热到70℃~80℃,目的是 .
(5)8.34g FeSO47H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图2所示.下列说法中正确的是
A.温度为78℃时固体物质M的化学式为FeSO45H2O
B.温度为159℃时固体物质N的化学式为FeSO43H2O
C.在隔绝空气条件下由N得到P的化学方程式为FeSO4 ![]() FeO+SO3↑
FeO+SO3↑
D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验.①用分析天平称取样品2.700g;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495g.若该聚铁主要成分为[Fe(OH)SO4]n , 则该聚铁中铁元素的质量分数为 .
【答案】
(1)![]()
(2)4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S
(3)Fe(或铁);蒸发结晶
(4)促进Fe3+的水解
(5)D
(6)31.1%
【解析】解:(1)铁为26号元素第ⅤⅢ族,四个电子层,最外层2个电子,原子结构示意图为: ![]() ,所以答案是:
,所以答案是: ![]() ;(2)反应物为FeS、O2和H2SO4 , 生成物有S,根据质量守恒还应有Fe2(SO4)3和H2O,反应的化学方程式为4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S,所以答案是:4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S;(3)溶液X中含有Fe3+ , 要制备绿矾,应加入Fe使之还原为Fe2+ , 加入铁可生成Fe2+ , 并且不引入新的杂质,过程④是溶液中得到溶质晶体可以通过蒸发结晶得到,所以答案是:Fe(或铁),蒸发结晶;(4)过程⑥目的为促进的水解,加热有利于水解的进行,促进Fe3+的水解,所以答案是:促进Fe3+的水解;(5)8.34g FeS047H20样品物质的量=
;(2)反应物为FeS、O2和H2SO4 , 生成物有S,根据质量守恒还应有Fe2(SO4)3和H2O,反应的化学方程式为4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S,所以答案是:4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S;(3)溶液X中含有Fe3+ , 要制备绿矾,应加入Fe使之还原为Fe2+ , 加入铁可生成Fe2+ , 并且不引入新的杂质,过程④是溶液中得到溶质晶体可以通过蒸发结晶得到,所以答案是:Fe(或铁),蒸发结晶;(4)过程⑥目的为促进的水解,加热有利于水解的进行,促进Fe3+的水解,所以答案是:促进Fe3+的水解;(5)8.34g FeS047H20样品物质的量= ![]() =0.03mol,其中m(H20)=0.03mol×7×18g/mol=3.78g,如晶体全部失去结晶水,固体的质量应为8.34g﹣3.78g=4.56g,可知在加热到373℃之前,晶体失去部分结晶水, A.温度为78℃时,固体质量为6.72g,其中m(FeS04)=0.03mol×152g/mol=4.56g,m(H20)=6.72g﹣4.56g=2.16g,n(H20)=
=0.03mol,其中m(H20)=0.03mol×7×18g/mol=3.78g,如晶体全部失去结晶水,固体的质量应为8.34g﹣3.78g=4.56g,可知在加热到373℃之前,晶体失去部分结晶水, A.温度为78℃时,固体质量为6.72g,其中m(FeS04)=0.03mol×152g/mol=4.56g,m(H20)=6.72g﹣4.56g=2.16g,n(H20)= ![]() =0.12mol,则n(H20):n(FeS04)=0.12mol:0.03mol=4:1,则化学式为FeSO44H2O,故A错误;
=0.12mol,则n(H20):n(FeS04)=0.12mol:0.03mol=4:1,则化学式为FeSO44H2O,故A错误;
B.温度为l59℃时,固体质量为5.10g,其中m(FeS04)=0.03mol×152g/mol=4.56g,m(H20)=5.10g﹣4.56g=0.54g,n(H20)= ![]() =0.03mol,则n(H20):n(FeS04)=0.03mol:0.03mol=1:1,则化学式为FeSO4H2O,故B错误; C.m(FeS04)=0.03mol×152g/mol=4.56g,则在隔绝空气条件下由N得到P的化学方程式为FeSO4H2O
=0.03mol,则n(H20):n(FeS04)=0.03mol:0.03mol=1:1,则化学式为FeSO4H2O,故B错误; C.m(FeS04)=0.03mol×152g/mol=4.56g,则在隔绝空气条件下由N得到P的化学方程式为FeSO4H2O ![]() FeS04+H20,故C错误; D.加热至633℃时,固体的质量为2.40g,其中n(Fe)=n( FeS047H20)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g﹣1.68g=0.72g,n(O)=
FeS04+H20,故C错误; D.加热至633℃时,固体的质量为2.40g,其中n(Fe)=n( FeS047H20)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g﹣1.68g=0.72g,n(O)= ![]() =0.045mol,则n(Fe):n(O)=0.03mol:0.045mol=2:3,则固体物质Q的化学式为Fe2O3 , 故D正确.故选D.所以答案是:D.(6)过滤、洗涤、干燥,称量,得固体质量为3.495g,应为BaSO4沉淀, n(BaSO4)=
=0.045mol,则n(Fe):n(O)=0.03mol:0.045mol=2:3,则固体物质Q的化学式为Fe2O3 , 故D正确.故选D.所以答案是:D.(6)过滤、洗涤、干燥,称量,得固体质量为3.495g,应为BaSO4沉淀, n(BaSO4)= ![]() =0.015mol,则n(Fe3+)=n(SO42﹣)=0.015mol,
=0.015mol,则n(Fe3+)=n(SO42﹣)=0.015mol,
m(Fe)=0.015mol×56g/mol=0.84g,ω(Fe)= ![]() ×100%=31.1%,所以答案是:31.1%
×100%=31.1%,所以答案是:31.1%

【题目】下列用品的有效成分与用途对应有错误的是( )
A | B | C | D | |
用品 | 食盐 | 水玻璃 | 复方氢氧化铝片 | 84消毒液 |
有效成分 | NaCl | Na2SiO3 | Al(OH)3 | NaClO |
用途 | 做调味品 | 刻蚀玻璃 | 做抗酸药 | 做消毒剂 |
A. AB. BC. CD. D