题目内容
请你设计实验探究促进或抑制FeCl3水解的条件,了解影响盐类水解程度的因素.
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、酒精灯、pH计、pH试纸;lmol/L盐酸、氯化氢气体、1mol/L氢氧化钠、lmol/L氯化铁、蒸馏水.
完成下列探究过程:
(1)写出FeCl3水解的离子方程式:______.
(2)针对FeCl3水解的影响因素提出假设:
假设 l:溶液的酸碱性;
假设 2:______;
假设 3:______.
(3)基于以上3个假设,设计出实验方案,将实验操作、预期的实验现象和结论填在下表中.
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、酒精灯、pH计、pH试纸;lmol/L盐酸、氯化氢气体、1mol/L氢氧化钠、lmol/L氯化铁、蒸馏水.
完成下列探究过程:
(1)写出FeCl3水解的离子方程式:______.
(2)针对FeCl3水解的影响因素提出假设:
假设 l:溶液的酸碱性;
假设 2:______;
假设 3:______.
(3)基于以上3个假设,设计出实验方案,将实验操作、预期的实验现象和结论填在下表中.
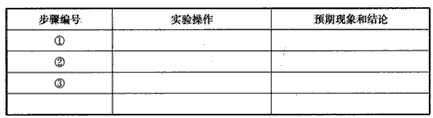
| 步骤编号 | 实验操作 | 预期现象和结论 |
| ① | ______ | ______ |
| ② | ______ | ______ |
| ③ | ______ | ______ |
| ______ | ______ | |
| … | … | … |
(1)氯化铁是强酸弱碱盐能水解生成氢氧化铁和盐酸,所以其水解方程式为Fe3++3H2O?Fe(OH)3+3H+.
故答案为:Fe3++3H2O?Fe(OH)3+3H+.
(2)影响盐类水解的因素有:溶液的浓度、溶液的温度、和溶液的酸碱性.
故答案为:氯化铁溶液的浓度;溶液的温度.
(3)①给溶液加热,观察溶液颜色的变化,如果溶液颜色变深,说明升高温度能促进氯化铁的水解,生成更多的氢氧化铁胶体.
②向溶液中通入氯化氢气体,氯化氢溶于水后,氯化氢电离出自由移动的氢离子,即酸的浓度增大,如果溶液颜色变浅,说明加入酸后能抑制氯化铁水解.
③用量筒量取10ml lmol/L氯化铁于烧杯中,用pH计测出pH值.另取90ml蒸馏水加入烧杯,充分搅拌,再用pH计测出pH值,如果前后测得pH值之差小于1.说明加水稀释后平衡右移,生成更多的H+.故增大氯化铁浓度,不利其水解.
故答案为:
故答案为:Fe3++3H2O?Fe(OH)3+3H+.
(2)影响盐类水解的因素有:溶液的浓度、溶液的温度、和溶液的酸碱性.
故答案为:氯化铁溶液的浓度;溶液的温度.
(3)①给溶液加热,观察溶液颜色的变化,如果溶液颜色变深,说明升高温度能促进氯化铁的水解,生成更多的氢氧化铁胶体.
②向溶液中通入氯化氢气体,氯化氢溶于水后,氯化氢电离出自由移动的氢离子,即酸的浓度增大,如果溶液颜色变浅,说明加入酸后能抑制氯化铁水解.
③用量筒量取10ml lmol/L氯化铁于烧杯中,用pH计测出pH值.另取90ml蒸馏水加入烧杯,充分搅拌,再用pH计测出pH值,如果前后测得pH值之差小于1.说明加水稀释后平衡右移,生成更多的H+.故增大氯化铁浓度,不利其水解.
故答案为:
| 步骤编号 | 实验操作 | 预期现象和结论 |
| ① | 在试管中加入2ml lmol/L氯化铁,观察溶液颜色,加热一段时间. | 加热后溶液颜色变深. 说明升温促进氯化铁水解,生成更多的氢氧化铁胶体. |
| ② | 在上述溶液中通入HCl气体 | 上述溶液颜色变浅.说明加入酸使平衡左移,酸抑制氯化铁水解. |
| ③ | 用量筒取10ml lmol/L氯化铁于烧杯中,用pH计测出pH值.另取90ml蒸馏水加入烧杯,充分搅拌,再用pH计测出pH值. | 前后测得pH值之差小于1.说明加水稀释后平衡右移,生成更多的H+.故增大氯化铁浓度,不利其水解. |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
请你设计实验探究促进或抑制FeCl3水解的条件,了解影响盐类水解程度的因素.
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、酒精灯、pH计、pH试纸;lmol/L盐酸、氯化氢气体、1mol/L氢氧化钠、lmol/L氯化铁、蒸馏水.
完成下列探究过程:
(1)写出FeCl3水解的离子方程式:______.
(2)针对FeCl3水解的影响因素提出假设:
假设 l:溶液的酸碱性;
假设 2:______;
假设 3:______.
(3)基于以上3个假设,设计出实验方案,将实验操作、预期的实验现象和结论填在下表中.
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、酒精灯、pH计、pH试纸;lmol/L盐酸、氯化氢气体、1mol/L氢氧化钠、lmol/L氯化铁、蒸馏水.
完成下列探究过程:
(1)写出FeCl3水解的离子方程式:______.
(2)针对FeCl3水解的影响因素提出假设:
假设 l:溶液的酸碱性;
假设 2:______;
假设 3:______.
(3)基于以上3个假设,设计出实验方案,将实验操作、预期的实验现象和结论填在下表中.
| 步骤编号 | 实验操作 | 预期现象和结论 |
| ① | ______ | ______ |
| ② | ______ | ______ |
| ③ | ______ | ______ |
| ______ | ______ | |
| … | … | … |
 请回答:
请回答: