题目内容
19.将含Ca元素质量为20克的CaCl2固体溶于一定量水中形成溶液的体积为500mL,求CaCl2及Cl-的物质的量浓度.分析 根据n=$\frac{m}{M}$计算出20g钙离子的物质的量,再结合氯化钙的化学式计算出氯化钙的物质的量,最后根据c=$\frac{n}{V}$计算出CaCl2及Cl-的物质的量浓度.
解答 解:20g钙离子的物质的量为:$\frac{20g}{20g/mol}$=1mol,
根据化学式CaCl2可知氯化钙的物质的量也是1mol,其浓度为:c(CaCl2)=$\frac{1mol}{0.5L}$=1mol/L;
该溶液中氯离子的浓度为:c(Cl-)=2c(CaCl2)=2mol/L,
答:CaCl2及Cl-的物质的量浓度分别为c(CaCl2)=1mol/L、c(Cl-)=2mol/L.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式即可解答,注意掌握物质的量与物质的量浓度、摩尔质量之间的转化关系.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
7.从溴乙烷制取1,2-二溴乙烷,下列制备方案中最好的是( )
| A. | CH3CH2Br$\stackrel{NaOH水溶液}{→}$CH3CH2OH$\stackrel{浓硫酸,170℃}{→}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2=CH2$\stackrel{Br_{2}}{→}$CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br |
14.甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀; 甲+丙→沉淀; 乙+丙→沉淀; 丙十丁→沉淀;乙+丁→无色无味气体.则甲、乙、丙、丁四种溶液依次是( )
| A. | BaCl2 Na2CO3 AgNO3 盐酸 | B. | BaCl2 Na2CO3 盐酸 AgNO3 | ||
| C. | Na2CO3 盐酸 AgNO3 BaCl2 | D. | AgNO3 盐酸 BaCl2 Na2CO3 |
11.在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是( )
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2═Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n(HNO3(稀))═1:3 4Fe+12H++3NO3-=3Fe2++Fe3++3NO↑+6H2O |
9.氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它.CuH不稳定,易分解:CuH在氯气中能燃烧;跟盐酸反应能产生气体,以下有关它的推断中错误的是( )
| A. | “另一种反应物”一定只具有氧化性 | B. | “另一种反应物”一定具有还原性 | ||
| C. | 点燃时:2CuH+3Cl2═2CuCl2+2HCl | D. | CuH 既可做氧化剂也可做还原剂 |

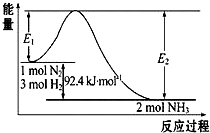 合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=“Q“kJ•mol-1,能量变化如图所示,回答下列问题:
合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=“Q“kJ•mol-1,能量变化如图所示,回答下列问题: