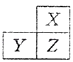题目内容
【题目】已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO.反应如下: Ca3(PO4)2+SiO2+C ![]() CaSiO3+P4↑+CO↑
CaSiO3+P4↑+CO↑
(1)配平该反应方程式,并标出电子转移方向和数目. Ca3(PO4)2+SiO2+C ![]() CaSiO3+P4↑+CO↑
CaSiO3+P4↑+CO↑
(2)该反应中被还原的元素是 , 氧化产物是 .
(3)每消耗24.0g碳时,有个电子发生转移,生成P4g.
(4)反应所得混合气体,折算成标况下,其气体密度为g/L(保留两位小数).与该反应中涉及到的磷元素相同主族的氮元素,是造成水体富营养化的主要原因.若某污水中NH4Cl含量为180mg/L.
(5)写出NH4Cl的电子式 .
(6)为除去废水中的NH4+ , 向103L该污水中加入0.1mol/LNaOH溶液,发生如下反应:NH4++OH﹣→NH3+H2O.则理论上需要NaOH溶液的体积为L(计算结果保留两位小数)
【答案】
(1)2;6;10;6;1;10; 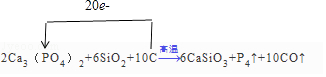
(2)p; CO
(3)4NA;24.8
(4)1.64
(5)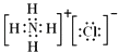
(6)33.64
【解析】解:(1)在此反应中Ca3(PO4)2中P元素价态从+5降低到0价的P4,化合价降低了20,C从0价升高到+2价的CO,化合价升高了+2价,最小公倍数为20,故P4前系数为1,CO前系数为10,并根据原子守恒配平,故方程式2Ca3(PO4)2+6SiO2+10C ![]() 6CaSiO3+P4↑+10CO↑故方程式前面的系数为:2;6;10;6;1;10;单线桥表示
6CaSiO3+P4↑+10CO↑故方程式前面的系数为:2;6;10;6;1;10;单线桥表示 
所以答案是:2;6;10;6;1;10; 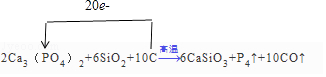
;(2)据Ca3(PO4)2中P元素的化合价由+5价降低为0,化合价降低,故作氧化剂,又因为氧化剂具有氧化性被还原,故P元素被还原;C元素由0价升高到+2价的
CO,化合价升高,做还原剂,得到的CO是氧化产物,
所以答案是:P;CO;(3)(3)每消耗24.0g碳时,转移电子为 ![]() ×(2﹣0)=4mol,N=nNA=4NA,由反应可知,消耗10molC生成1molP4,其质量为0.2mol×124g/mol=24.8g
×(2﹣0)=4mol,N=nNA=4NA,由反应可知,消耗10molC生成1molP4,其质量为0.2mol×124g/mol=24.8g
所以答案是:4NA;24.8;(4)(4)由反应可知,混合气体的质量为24.8g+2mol×28g/mol=80.8g,标况下体积为2.2mol×22.4L/mol=49.28L,所以密度为 ![]() =1.64g/L
=1.64g/L
所以答案是:1.64(5)氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: 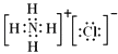 ,
,
所以答案是: 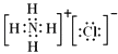 ;(6)
;(6)
由NH4Cl~~~~ | NaOH |
53.3g | 1mol |
180mg/L×103 L×103 g/mg | 0.1mol/L×V |
![]() =
= ![]() 解之得:V=33.64L
解之得:V=33.64L
所以答案是:33.64.