题目内容
【题目】设NA代表阿伏加德罗常数的值,下列叙述正确的是
A. 常温常压下,22. 4 L乙烷和乙烯含碳原子数为2NA
B. 室温下,42.0 g乙烯含C—H键为3NA
C. 标准状况下,2.24 L甲烷和乙烯混合气体中含氢原子数为0.4NA
D. 标准状况下,22.4 L苯所含的分子数为NA
【答案】C
【解析】A.常温常压,Vm≠22.4L/mol;B.质量和微粒数目之间的关系式:N=nNA=![]() NA,1个C2H4含有的C—H数为4个,据此解答;C.1个CH4和1个C2H4分子均含有4个氢原子;
NA,1个C2H4含有的C—H数为4个,据此解答;C.1个CH4和1个C2H4分子均含有4个氢原子;
D.气体摩尔体积适应对象为气体。
A.常温常压,Vm≠22.4L/mol,无法计算乙烷和乙烯的物质的量,故A错误;
B.42.0 g乙烯的物质的量为![]() =1.5mol,含有的含C—H键数为6NA,所以B选项是错误的;
=1.5mol,含有的含C—H键数为6NA,所以B选项是错误的;
C.标准状况下,22.4L甲烷和乙烯物质的量为![]() =0.1mol,所含氢原子数为0.4NA,故C正确;
=0.1mol,所含氢原子数为0.4NA,故C正确;
D.标况下,苯为液体,不能使用气体摩尔体积,故D错误;
所以C选项是正确的。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】现有反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的 ( )
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(molL﹣1) | V/mL | c/(molL﹣1) | V/mL | ||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
A.A
B.B
C.C
D.D
【题目】I、某实验小组同学探究铜与硝酸的反应。
(1)用浓硝酸和水按照不同体积比配成不同浓度的硝酸溶液,各取10 mL硝酸溶液分别与铜片反应,实验记录如下:
序号 | 浓硝酸与水的体积比 | 实验现象 |
Ⅰ | 1:1 | 反应速率快,溶液很快变成绿色,铜丝表面有大量气泡冒出,气体呈红棕色 |
Ⅱ | 1:3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
Ⅲ | 1:5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
①铜与稀硝酸反应的离子方程式为_______________________________________;
②依据上表,制备NO气体最适宜的是实验II,理由是__________________________
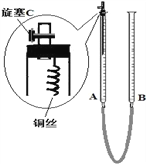
(2)为防止有毒气体逸散造成空气污染,该小组同学改进实验装置,如右图所示(夹持仪器略去)。用该装置进行铜与稀硝酸的反应并验证产生NO气体的性质,实验步骤如下:
Ⅰ.安装好装置后,检查装置气密性。
Ⅱ.打开旋塞C,从B管上端加入所选浓度的硝酸,至铜丝下沿(不接触铜丝)。
Ⅲ.向上移动B管,使A管液面上升至与橡皮塞恰好接触,关闭旋塞C,反应开始。
Ⅳ.当液面重新下降至与铜丝脱离接触时,反应停止。
Ⅴ.打开旋塞C,向下移动B管,使A中迅速进入少量空气,关闭旋塞C,观察现象。
①步骤Ⅰ中检查装置气密性的操作是:关闭旋塞C,从B管上端加入水,若观察到______________________________,说明装置的气密性良好。
②步骤Ⅲ操作的目的是________________________________________。
③步骤Ⅴ产生现象之后的化学反应离子方程式:_____________________________
Ⅱ、(3)高氯酸铵可用作火箭推进剂,已知:2NH4ClO4 ![]() N2↑+2O2↑+Cl2↑+4H2O。现可提供下列试剂:a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.Mg e.Cu f.Fe
N2↑+2O2↑+Cl2↑+4H2O。现可提供下列试剂:a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.Mg e.Cu f.Fe
利用下图装置对高氯酸铵受热分解产生的三种气体分别进行吸收或收集。
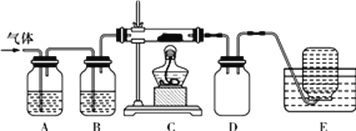
①E中收集到的气体可能是_______________(填化学式);
②A、B、C中盛放的药品依次可以是______________(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
Ⅰ.a、b、c Ⅱ.c、b、e Ⅲ.b、c、f

