题目内容
铝和铝合金是生活中常用的材料,下列说法正确的是
- A.铝合金的熔点比纯铝高
- B.铝合金的硬度比纯铝小
- C.镁铝合金腐蚀时,镁先于铝被腐蚀
- D.常温下可用铝制容器盛装浓硫酸
D
分析:A.合金的熔点比成分金属低,硬度比成分金属大;
B.合金的熔点比成分金属低,硬度比成分金属大;
C.铝表面能生成一种致密的氧化物薄膜;
D.常温下,铁铝在浓硫酸中发生钝化现象;
解答:A.合金的熔点比成分金属低,所以铝合金的熔点比纯铝低,故A正确;
B.合金的硬度比成分金属大,所以铝合金的硬度比纯铝大,故B错误;
C.铝氧化生成的氧化铝为致密物质,可以阻止里面的金属进一步被氧化,故C错误;
D.常温下,铁铝在浓硫酸中发生钝化现象,所以常温下可用铝制容器盛装浓硫酸,故D正确;
故选:D;
点评:本题考查了合金的有关知识,需要注意的是铁、铝都能和浓硫酸、浓硝酸在常温下发生钝化现象,所以可用铁、铝制容器盛放浓硫酸、浓硝酸.
分析:A.合金的熔点比成分金属低,硬度比成分金属大;
B.合金的熔点比成分金属低,硬度比成分金属大;
C.铝表面能生成一种致密的氧化物薄膜;
D.常温下,铁铝在浓硫酸中发生钝化现象;
解答:A.合金的熔点比成分金属低,所以铝合金的熔点比纯铝低,故A正确;
B.合金的硬度比成分金属大,所以铝合金的硬度比纯铝大,故B错误;
C.铝氧化生成的氧化铝为致密物质,可以阻止里面的金属进一步被氧化,故C错误;
D.常温下,铁铝在浓硫酸中发生钝化现象,所以常温下可用铝制容器盛装浓硫酸,故D正确;
故选:D;
点评:本题考查了合金的有关知识,需要注意的是铁、铝都能和浓硫酸、浓硝酸在常温下发生钝化现象,所以可用铁、铝制容器盛放浓硫酸、浓硝酸.

练习册系列答案
相关题目
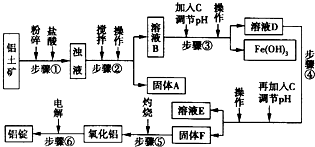
生活中常使用的铝合金中的铝来自于电解熔融氧化铝.用于工业电解的氧化铝要求其纯度不得低于98.2%,而天然铝土矿中的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等.工业生产铝锭的工艺流程示意图如下所示:
一些难溶物开始沉淀和完全沉淀的pH如表所示:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH(离子初始浓度为0.01mol、L) | 4 | 2.3 | 10.4 |
| 完全沉淀pH(离子浓度<10-5mol/L) | 5.2 | 4.1 | 12.4 |
(1)加入盐酸时,氧化铝与盐酸发生反应的离子方程式为______.
(2)步骤②③④中操作的名称为______.
(3)固体A的化学式为______;物质C的化学式为______:溶液中的Na+、Ca2+、Mg2+是在步骤______中除去的.
(4)步骤③中调节溶液pH的数值范围为______,步骤④中调节溶液pH的数值范围为______.
(5)步骤⑥中发生反应的化学方程式为______.
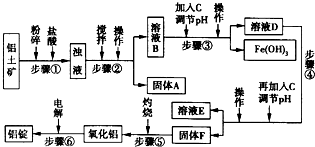
生活中常使用的铝合金中的铝来自于电解熔融氧化铝.用于工业电解的氧化铝要求其纯度不得低于98.2%,而天然铝土矿中的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等.工业生产铝锭的工艺流程示意图如下所示:
一些难溶物开始沉淀和完全沉淀的pH如表所示:
请回答下列问题:
(1)加入盐酸时,氧化铝与盐酸发生反应的离子方程式为______.
(2)步骤②③④中操作的名称为______.
(3)固体A的化学式为______;物质C的化学式为______:溶液中的Na+、Ca2+、Mg2+是在步骤______中除去的.
(4)步骤③中调节溶液pH的数值范围为______,步骤④中调节溶液pH的数值范围为______.
(5)步骤⑥中发生反应的化学方程式为______冰晶石4Al+3O2↑

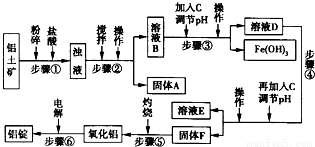
一些难溶物开始沉淀和完全沉淀的pH如表所示:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH(离子初始浓度为0.01mol、L) | 4 | 2.3 | 10.4 |
| 完全沉淀pH(离子浓度<10-5mol/L) | 5.2 | 4.1 | 12.4 |
(1)加入盐酸时,氧化铝与盐酸发生反应的离子方程式为______.
(2)步骤②③④中操作的名称为______.
(3)固体A的化学式为______;物质C的化学式为______:溶液中的Na+、Ca2+、Mg2+是在步骤______中除去的.
(4)步骤③中调节溶液pH的数值范围为______,步骤④中调节溶液pH的数值范围为______.
(5)步骤⑥中发生反应的化学方程式为______冰晶石4Al+3O2↑