题目内容
在标准状况下,与32gO2的体积相等的N2为( )A.质量为14g
B.分子数为6.02×1023
C.体积为22.4L
D.物质的量为2mol
【答案】分析:标准状况下,体积相等,则物质的量相等、分子数相等,利用n=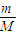 、m=n×M、N=n×NA、V=n×Vm来计算.
、m=n×M、N=n×NA、V=n×Vm来计算.
解答:解:32gO2的物质的量为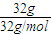 =1mol,因标准状况下,气体的体积相等,则物质的量相等、分子数相等,
=1mol,因标准状况下,气体的体积相等,则物质的量相等、分子数相等,
A、N2的质量应为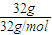 ×28g/mol=28g,故A错误;
×28g/mol=28g,故A错误;
B、N2的分子数为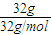 ×NA=6.02×1023,故B正确;
×NA=6.02×1023,故B正确;
C、N2的体积为 ×22.4L/mol=22.4L,故C正确;
×22.4L/mol=22.4L,故C正确;
D、N2的物质的量等于氧气的物质的量,即为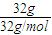 =1mol,故D错误;
=1mol,故D错误;
故选BC.
点评:本题考查有关物质的量的计算,明确标准状况下,气体的体积相等得出气体的物质的量相等、分子数相等是解答本题的关键.
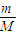 、m=n×M、N=n×NA、V=n×Vm来计算.
、m=n×M、N=n×NA、V=n×Vm来计算.解答:解:32gO2的物质的量为
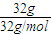 =1mol,因标准状况下,气体的体积相等,则物质的量相等、分子数相等,
=1mol,因标准状况下,气体的体积相等,则物质的量相等、分子数相等,A、N2的质量应为
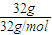 ×28g/mol=28g,故A错误;
×28g/mol=28g,故A错误;B、N2的分子数为
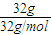 ×NA=6.02×1023,故B正确;
×NA=6.02×1023,故B正确;C、N2的体积为
 ×22.4L/mol=22.4L,故C正确;
×22.4L/mol=22.4L,故C正确;D、N2的物质的量等于氧气的物质的量,即为
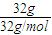 =1mol,故D错误;
=1mol,故D错误;故选BC.
点评:本题考查有关物质的量的计算,明确标准状况下,气体的体积相等得出气体的物质的量相等、分子数相等是解答本题的关键.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
 (2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.
(2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义. (选做题)
(选做题)