题目内容
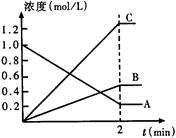
下图表示
(1)该反应的反应物是____________________。
(2)反应物的转化率是_______________________。
(3)该反应的化学方程式为__________________________________________________。
(1)A (2)40% (3)![]() B+
B+
解析:起始时A的浓度为2.0 mol·L-1,B、C的浓度为0,随着时间的推移,A的浓度降低为1.2 mol·L-1,C的浓度升高为1.2 mol·L-1,B的浓度升高为0.4 mol·L-1,t 1时刻后各物质浓度不再变化,说明反应已达平衡,得出A为反应物,B、C为生成物。它们浓度变化的差值之比为化学方程式中各物质的化学计量数之比。

练习册系列答案
相关题目
(共8分)
(1)(3分)有反应:2NO2 N2O4 △H<0,根据图像判断后填空:
N2O4 △H<0,根据图像判断后填空:
|
 t1 t2 t3 t4 t5 t6 t
t1 t2 t3 t4 t5 t6 tt1至t3采取的措施是_____________;t4至t5采取的措施是______________t6采取的措施是_________________。
(2)(3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 △H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640kJ/mol
请写出FeO(s)被CO(g)还原成Fe和CO2(g)的热化学方程式 。
(3)(2分)下图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。则该反应的化学方程式为________________________。