题目内容
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
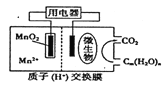
(1)+6价的Cr能引起细胞的突变而对人体不利,可用 Na2SO3 将Cr2O72—还原为Cr3+。该反应的离子反应方程式为___________。
(2)利用铬铁矿(FeOCr2O3)冶炼制取金属铬的工艺流程如图所示:
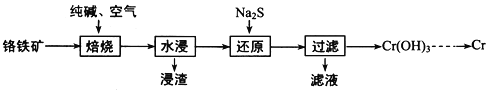
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是__________________________ 。
②“水浸”要获得浸出液的操作是_________________________________。浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则 “还原”操作中发生反应的离子方程式为___。
③加热Cr(OH)3可得到Cr2O3,从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是 _______。
(3)已知 Cr3+完全沉淀时溶液pH为5,(Cr3+浓度降至10-5molL-1可认为完全沉淀)则Cr(OH)3的溶度积常数 Ksp=_______________。
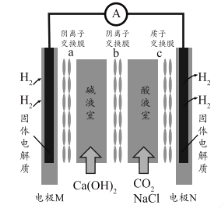
(4)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2Cr![]() +2H+
+2H+![]() Cr2
Cr2![]() + H2O)。
+ H2O)。
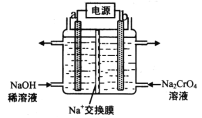
①电极b连接电源的______极(填“正”或“负”) , b 极发生的电极反应式为_________________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则理论上生成重铬酸钠的物质的量是 _______________mol 。
【答案】Cr2O72—+3SO32-+8H+=2Cr3++3SO42-+4H2O 铬铁矿粉碎 过滤 8CrO42—+3S2-+20H2O=8Cr(OH)3↓+3SO42-+16OH- CO高温还原Cr2O3(热还原法) 1×10-32 正 2H2O-4e-=O2↑+4H+ ![]()
【解析】
(1)分析元素化合价变化情况,依据得失电子守恒,原子个数守恒,得出离子反应方程式。
(2)①影响化学反应速率的因素:物质的表面积大小,表面积越大,反应速率越快。
②依据原子守恒和得失电子守恒,得出离子方程式。
③用Cr2O3制取金属Cr,可以采取CO高温还原Cr2O3(热还原法)。
(3)根据Ksp=c(Cr3+)c3(OH-)求算。
(4)①根据装置图和离子放电顺序得出阳极的电极反应式。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则溶液中移动的电荷为(a-b)mol,所以外电路转移的电子为(a-b)mol,阳极的电极反应为2H2O-4e-=O2↑+4H+,则阳极生成的氢离子为(a-b)mol。
(1)反应中铬元素化合价从+6价降为+3价,硫元素从+4价升高到+6价,依据得失电子守恒,原子个数守恒,离子反应方程式为Cr2O72—+3SO32-+8H+=2Cr3++3SO42-+4H2O,故答案为:Cr2O72—+3SO32-+8H+=2Cr3++3SO42-+4H2O。
(2)①影响化学反应速率的因素:物质的表面积大小,表面积越大,反应速率越快,为加快焙烧速率和提高原料的利用率,可采取的措施将铬铁矿粉碎,故答案为:铬铁矿粉碎。
②“水浸”要获得浸出液,要过滤出浸渣,采取的操作是过滤;浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,说明加入的Na2S被氧化成SO42-,Cr元素由+6价降为+3价,S元素由-2价升到+6价,依据原子守恒和得失电子守恒,得到反应为:8CrO42—+3S2-+20H2O=8Cr(OH)3↓+3SO42-+16OH-,故答案为:过滤;8CrO42—+3S2-+20H2O=8Cr(OH)3↓+3SO42-+16OH-。
③从工业成本角度考虑,用Cr2O3制取金属Cr,可以采取CO高温还原Cr2O3(热还原法),故答案为:CO高温还原Cr2O3(热还原法)。
(3)pH为5,c(OH-)=10-9,Ksp=c(Cr3+)c3(OH-)=10-5×(10-9)3=1×10-32,故答案为:1×10-32。
(4)①根据图示,在b极所在电极室得到Na2Cr2O7,根据2CrO42-+2H+![]() Cr2O72—+ H2O ,电解过程中b极c(H+)增大,则b极电极反应式为2H2O-4e-=O2↑+4H+,a是阴极,b是阳极,电极b连接电源的正极,故答案为:正;2H2O-4e-=O2↑+4H+。
Cr2O72—+ H2O ,电解过程中b极c(H+)增大,则b极电极反应式为2H2O-4e-=O2↑+4H+,a是阴极,b是阳极,电极b连接电源的正极,故答案为:正;2H2O-4e-=O2↑+4H+。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则溶液中移动的电荷为(a-b)mol,阴极电极反应式为2H2O+2e-=H2↑+2OH-,则电路中通过电子物质的量为(a-b)mol;阳极的电极反应式为2H2O-4e-=O2↑+4H+,则阳极生成的氢离子为(a-b)mol,结合2CrO42-+2H+![]() Cr2O72—+ H2O,所以阳极生成的Cr2O72—物质的量是
Cr2O72—+ H2O,所以阳极生成的Cr2O72—物质的量是![]() mol,故答案为:
mol,故答案为:![]() 。
。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:
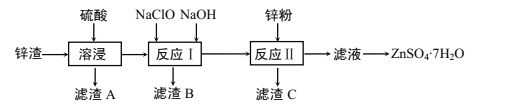
(1)“溶浸”操作中,选用“锌渣”而不选择氧化锌矿粉的原因是______;该操作中不断通入高温水蒸气的目的是________。
(2)“滤渣A”的主要成分是________。
(3)“反应Ⅰ”中,加入NaClO反应的离子方程式为___。
(4)“反应Ⅰ”中,再加入NaOH调节pH约为4.5,则“滤渣B”的主要成分是_____(填化学式)。(Ksp[Zn(OH)2]=3×10-17,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.8×10-39)
(5)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________。
(6)取28.7gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为_________(填字母标号)。
A.ZnO B.Zn3O(SO4)2 C.ZnSO4 D.ZnSO4·H2O