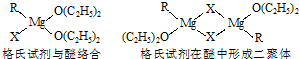
题目内容
在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH物质的量和所得沉淀的物质的量的关系如图所示,则:
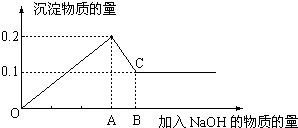
(1)图中C点表示当加入
(2)图中线段OA:AB=

(1)图中C点表示当加入
0.6
0.6
摩尔NaOH时,Al3+已经全部转化为偏铝酸根离子
全部转化为偏铝酸根离子
,Mg2+已经完全转化为氢氧化镁
完全转化为氢氧化镁
(2)图中线段OA:AB=
5:1
5:1
.分析:氯化镁和氯化铝均可以和氢氧化钠发生反应,生成沉淀氢氧化镁和氢氧化铝,氢氧化铝能和氢氧化钠继续反应,直至氢氧化铝全部被消耗,根据n(MgCl2)=n(Mg(OH)2],n(Al3+)=n(NaAlO2)=n(Al(OH)3)结合原子守恒知识来回答即可.
解答:解:根据图象可知,在滴加NaOH溶液到加入氢氧化钠为Amol时,沉淀量最大为0.2mol,说明氯化铝、氯化镁恰好完全反应,此时溶液为氯化钠溶液.继续滴加氢氧化钠,但在加入(B-A)mol时,沉淀物质的量最小为0.1mol,是氢氧化镁沉淀,所以加入Amol氢氧化钠是沉淀中有氢氧化镁0.1mol、氢氧化铝0.1mol;此时溶液为氯化钠、偏铝酸钠溶液.
(1)根据氢氧根守恒可知,沉淀量最大时加入的氢氧化钠n(NaOH)=2n[Mg(OH)2]+3n[Al(OH)3]=2×0.1mol+3×0.1mol=0.5mol,C点氢氧化铝完全溶解,
根据铝元素、钠元素守恒可知n(NaAlO2)=n[Al(OH)3]=0.1mol,
所以溶解氢氧化铝加入的氢氧化钠为0.1mol.
所以加入的氢氧化钠的物质的量为0.5mol+0.1mol=0.6mol;
C点氢氧化铝完全溶解,铝元素在溶液中以AlO2-存在.
故答案为:0.6;全部转化为偏铝酸根离子;完全转化为氢氧化镁;
(2)OA表示滴加NaOH溶液是镁离子、铝离子完全沉淀是需要的氢氧化钠的物质的量,沉淀量最大时加入的氢氧化钠n(NaOH)=2n[Mg(OH)2]+3n[Al(OH)3]=2×0.1mol+3×0.1mol=0.5mol;
AB表示溶解0.1mol氢氧化铝消耗的氢氧化钠的物质的量n(NaOH)=n[Al(OH)3]=0.1mol,
所以线段OA:AB=0.5mol:0.1mol=5:1.
故答案为:5:1.
(1)根据氢氧根守恒可知,沉淀量最大时加入的氢氧化钠n(NaOH)=2n[Mg(OH)2]+3n[Al(OH)3]=2×0.1mol+3×0.1mol=0.5mol,C点氢氧化铝完全溶解,
根据铝元素、钠元素守恒可知n(NaAlO2)=n[Al(OH)3]=0.1mol,
所以溶解氢氧化铝加入的氢氧化钠为0.1mol.
所以加入的氢氧化钠的物质的量为0.5mol+0.1mol=0.6mol;
C点氢氧化铝完全溶解,铝元素在溶液中以AlO2-存在.
故答案为:0.6;全部转化为偏铝酸根离子;完全转化为氢氧化镁;
(2)OA表示滴加NaOH溶液是镁离子、铝离子完全沉淀是需要的氢氧化钠的物质的量,沉淀量最大时加入的氢氧化钠n(NaOH)=2n[Mg(OH)2]+3n[Al(OH)3]=2×0.1mol+3×0.1mol=0.5mol;
AB表示溶解0.1mol氢氧化铝消耗的氢氧化钠的物质的量n(NaOH)=n[Al(OH)3]=0.1mol,
所以线段OA:AB=0.5mol:0.1mol=5:1.
故答案为:5:1.
点评:考查镁、铝化合物反应的混合计算,难度中等,关键是根据图象分析,明确每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析.注意守恒思想的运用,使计算简化.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目